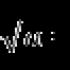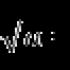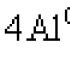Calciummetall oder nicht. Calcium in der Natur (3,4 % in der Erdkruste)
Calcium ist ein Element der Hauptuntergruppe der zweiten Gruppe, der vierten Periode des Periodensystems der chemischen Elemente, mit der Ordnungszahl 20. Es wird mit dem Symbol Ca (lat. Calcium) bezeichnet. Die einfache Substanz Calcium (CAS-Nummer: 7440-70-2) ist ein weiches, reaktives Erdalkalimetall, silbrig weiße Farbe.
Geschichte und Herkunft des Namens
Der Name des Elements kommt von lat. calx (im Genitiv calcis) - "Kalk", "weicher Stein". Es wurde von dem englischen Chemiker Humphrey Davy vorgeschlagen, der 1808 Calciummetall durch die elektrolytische Methode isolierte. Davy elektrolysierte eine Mischung aus nassem gelöschtem Kalk mit Quecksilberoxid HgO auf einer Platinplatte, die die Anode war. Als Kathode diente ein in flüssiges Quecksilber getauchter Platindraht. Als Ergebnis der Elektrolyse wurde Calciumamalgam erhalten. Nachdem Davy Quecksilber daraus vertrieben hatte, erhielt er ein Metall namens Kalzium.
Calciumverbindungen - Kalkstein, Marmor, Gips (sowie Kalk - ein Produkt des Brennens von Kalkstein) werden seit mehreren Jahrtausenden im Bauwesen verwendet. Bis zum Ende des 18. Jahrhunderts betrachteten Chemiker Kalk als einfachen Körper. 1789 schlug A. Lavoisier vor, dass Kalk, Magnesia, Schwerspat, Tonerde und Kieselerde komplexe Substanzen sind.
Kassenbon
Freies metallisches Calcium wird durch Elektrolyse einer Schmelze bestehend aus CaCl 2 (75–80 %) und KCl oder aus CaCl 2 und CaF 2 sowie aluminothermische Reduktion von CaO bei 1170–1200 °C gewonnen:
4CaO + 2Al → CaAl 2 O 4 + 3Ca.
Physikalische Eigenschaften
Calciummetall existiert in zwei allotropen Modifikationen. Bis 443 °C ist α-Ca mit kubisch flächenzentriertem Gitter stabil (Parameter a = 0,558 nm), darüber ist β-Ca stabil mit kubisch raumzentriertem Gitter vom Typ α-Fe (Parameter a = 0,448 nm). Die Standardenthalpie ΔH 0 des α → β-Übergangs beträgt 0,93 kJ/mol.
Mit einer allmählichen Druckerhöhung beginnt es, die Eigenschaften eines Halbleiters zu zeigen, wird aber kein Halbleiter im vollen Sinne des Wortes (es ist auch kein Metall mehr). Bei einer weiteren Druckerhöhung kehrt es in den metallischen Zustand zurück und beginnt, supraleitende Eigenschaften zu zeigen (die Supraleitungstemperatur ist sechsmal höher als die von Quecksilber und übertrifft alle anderen Elemente in der Leitfähigkeit bei weitem). Das einzigartige Verhalten von Calcium ähnelt in vielerlei Hinsicht dem von Strontium (d. h. die Parallelen im Periodensystem bleiben erhalten).
Chemische Eigenschaften
Calcium ist ein typisches Erdalkalimetall. Die chemische Aktivität von Calcium ist hoch, aber geringer als die aller anderen Erdalkalimetalle. Es reagiert leicht mit Sauerstoff, Kohlendioxid und Feuchtigkeit in der Luft, weshalb die Oberfläche von Calciummetall normalerweise mattgrau ist, weshalb Calcium im Labor normalerweise wie andere Erdalkalimetalle in einem dicht verschlossenen Glas unter einer Schicht aufbewahrt wird aus Kerosin oder flüssigem Paraffin.
Calcium ist ein chemisches Element der Gruppe II mit der Ordnungszahl 20 im Periodensystem, gekennzeichnet durch das Symbol Ca (lat. Calcium). Calcium ist ein weiches, silbergraues Erdalkalimetall.
20 Element des Periodensystems Der Name des Elements kommt von lat. calx (im Genitiv calcis) - "Kalk", "weicher Stein". Es wurde vom englischen Chemiker Humphry Davy vorgeschlagen, der 1808 metallisches Calcium isolierte.
Calciumverbindungen - Kalkstein, Marmor, Gips (sowie Kalk - ein Produkt des Brennens von Kalkstein) werden seit mehreren Jahrtausenden im Bauwesen verwendet.
Calcium ist eines der am häufigsten vorkommenden Elemente auf der Erde. Calciumverbindungen kommen in fast allen tierischen und pflanzlichen Geweben vor. Es macht 3,38 % der Masse der Erdkruste aus (Platz 5 im Überfluss nach Sauerstoff, Silizium, Aluminium und Eisen).
Calcium in der Natur finden
Aufgrund der hohen chemischen Aktivität kommt Calcium in freier Form in der Natur nicht vor.
Calcium macht 3,38 % der Masse der Erdkruste aus (Platz 5 im Überfluss nach Sauerstoff, Silizium, Aluminium und Eisen). Elementinhalt in Meerwasser- 400 mg/l.
Isotope
Calcium kommt in der Natur in Form einer Mischung aus sechs Isotopen vor: 40Ca, 42Ca, 43Ca, 44Ca, 46Ca und 48Ca, von denen das häufigste – 40Ca – 96,97 % ausmacht. Calciumkerne enthalten die magische Zahl an Protonen: Z = 20. Isotope
40
20
Ca20 und
48
20
Ca28 sind zwei der fünf in der Natur vorkommenden doppelt magischen Zahlenkerne.
Von den sechs natürlich vorkommenden Calciumisotopen sind fünf stabil. Das sechste 48Ca-Isotop, das schwerste der sechs und sehr selten (seine Isotopenhäufigkeit beträgt nur 0,187 %), unterliegt einem doppelten Beta-Zerfall mit einer Halbwertszeit von 1,6 · 1017 Jahren.
In Steinen und Mineralien
Das meiste Kalzium ist in der Zusammensetzung von Silikaten und Alumosilikaten verschiedener Gesteine (Granit, Gneise usw.) enthalten, insbesondere in Feldspat - Anorthit Ca.
In Form von Sedimentgesteinen werden Calciumverbindungen durch Kreide und Kalkstein repräsentiert, die hauptsächlich aus dem Mineral Calcit (CaCO3) bestehen. Die kristalline Form von Calcit, Marmor, kommt in der Natur viel seltener vor.
Weit verbreitet sind Calciumminerale wie Calcit CaCO3, Anhydrit CaSO4, Alabaster CaSO4 0,5H2O und Gips CaSO4 2H2O, Fluorit CaF2, Apatite Ca5(PO4)3(F,Cl,OH), Dolomit MgCO3 CaCO3. Das Vorhandensein von Calcium- und Magnesiumsalzen in Natürliches Wasser seine Härte wird bestimmt.
Calcium, das in der Erdkruste stark wandert und sich in verschiedenen geochemischen Systemen anreichert, bildet 385 Minerale (vierter nach der Anzahl der Minerale).
Die biologische Rolle von Calcium
Calcium ist ein häufiger Makronährstoff in Pflanzen, Tieren und Menschen. Bei Menschen und anderen Wirbeltieren befindet sich das meiste davon im Skelett und in den Zähnen. Kalzium kommt in Knochen in Form von Hydroxyapatit vor. Von verschiedene Formen Calciumcarbonat (Kalk) besteht aus den "Skeletten" der meisten Gruppen von Wirbellosen (Schwämme, Korallenpolypen, Weichtiere usw.). Calciumionen sind an Blutgerinnungsprozessen beteiligt und dienen auch als einer der universellen sekundären Botenstoffe in Zellen und regulieren eine Vielzahl intrazellulärer Prozesse - Muskelkontraktion, Exozytose, einschließlich der Sekretion von Hormonen und Neurotransmittern. Die Konzentration von Calcium im Zytoplasma menschlicher Zellen beträgt etwa 10−4 mmol/l, in Interzellularflüssigkeiten etwa 2,5 mmol/l.
Der Calciumbedarf ist altersabhängig. Für Erwachsene im Alter von 19 bis 50 Jahren und Kinder im Alter von 4 bis einschließlich 8 Jahren beträgt der Tagesbedarf (RDA) 1000 mg (enthalten in etwa 790 ml Milch mit einem Fettgehalt von 1 %) und für Kinder im Alter von 9 bis einschließlich 18 Jahren - 1300 mg pro Tag (enthalten in ca. 1030 ml Milch mit einem Fettgehalt von 1 %). Konsum während der Pubertät genügend Kalzium ist wegen des intensiven Wachstums des Skeletts sehr wichtig. Allerdings erreichen laut US-Forschung nur 11 % der Mädchen und 31 % der Jungen im Alter von 12 bis 19 Jahren ihre Bedürfnisse. Bei einer ausgewogenen Ernährung gelangt der größte Teil des Calciums (ca. 80 %) mit Milchprodukten in den Körper des Kindes. Das restliche Kalzium stammt aus Getreide (einschließlich Vollkornbrot und Buchweizen), Hülsenfrüchten, Orangen, Gemüse, Nüssen. Milchprodukte auf Basis von Milchfett (Butter, Sahne, Sauerrahm, Sahneeis) enthalten praktisch kein Calcium. Je mehr drin Milchprodukt Milchfett, desto weniger Calcium enthält es. Die Kalziumabsorption im Darm erfolgt auf zwei Arten: transzellulär (transzellulär) und interzellulär (parazellulär). Der erste Mechanismus wird durch die Wirkung der aktiven Form von Vitamin D (Calcitriol) und seiner Darmrezeptoren vermittelt. Er spielt große Rolle bei geringer bis mäßiger Kalziumzufuhr. Mit einem höheren Calciumgehalt in der Nahrung beginnt die interzelluläre Absorption die Hauptrolle zu spielen, was mit einem großen Gradienten der Calciumkonzentration einhergeht. Aufgrund des transzellulären Mechanismus wird Calcium verstärkt im Duodenum resorbiert (aufgrund der dort höchsten Konzentration an Rezeptoren im Calcitriol). Aufgrund des interzellulären passiven Transfers ist die Kalziumabsorption in allen drei Abschnitten des Dünndarms am aktivsten. Die Kalziumaufnahme wird parazellulär durch Laktose (Milchzucker) gefördert.
Die Kalziumaufnahme wird durch einige tierische Fette (einschließlich Kuhmilchfett und Rinderfett, aber nicht Schmalz) und Palmöl behindert. Die darin enthaltenen Palmitin- und Stearinfettsäuren werden bei der Verdauung im Darm abgespalten und binden in freier Form Calcium fest unter Bildung von Calciumpalmitat und Calciumstearat (unlösliche Seifen). In Form dieser Seife mit Stuhl gehen sowohl Kalzium als auch Fett verloren. Dieser Mechanismus ist verantwortlich für eine verringerte Calciumabsorption, eine verringerte Knochenmineralisierung und eine verringerte indirekte Messung der Knochenfestigkeit bei Säuglingen mit Säuglingsanfangsnahrung auf Palmölbasis (Palmolein). Bei diesen Kindern ist die Bildung von Calciumseifen im Darm mit einer Verhärtung des Stuhls, einer Abnahme seiner Häufigkeit sowie häufigerem Aufstoßen und Koliken verbunden.
Die Konzentration von Calcium im Blut aufgrund seiner Bedeutung für eine große Anzahl lebenswichtige Prozesse werden genau reguliert und bei richtiger Ernährung und ausreichender Zufuhr von fettarmen Milchprodukten und Vitamin D kommt es nicht zu einem Mangel. Ein längerer Mangel an Calcium und/oder Vitamin D in der Nahrung führt zu einem erhöhten Osteoporoserisiko und verursacht Rachitis im Säuglingsalter.
Übermäßige Dosen von Calcium und Vitamin D können eine Hyperkalzämie verursachen. Die maximale sichere Dosis für Erwachsene im Alter von 19 bis einschließlich 50 Jahren beträgt 2500 mg pro Tag (etwa 340 g Edamer Käse).
Calcium kommt in der Natur in Form sehr häufig vor verschiedene Verbindungen. In der Erdkruste belegt es mit 3,25% den fünften Platz und kommt am häufigsten in Form von Kalkstein CaCO3, Dolomit CaCO3 * MgCO3, Gips CaSO4 * 2H2O, Phosphorit Ca3 (PO4) 2 und Flussspat CaF2 vor, wobei es nicht wesentlich ist Anteil von Calcium in der Zusammensetzung von Silikatgesteinen. Meerwasser enthält durchschnittlich 0,04 % (w/w) Calcium
Physikalische und chemische Eigenschaften von Calcium
Calcium gehört zur Untergruppe der Erdalkalimetalle der Gruppe II des Periodensystems der Elemente; Seriennummer 20, Atomgewicht 40,08, Wertigkeit 2, Atomvolumen 25,9. Calciumisotope: 40 (97 %), 42 (0,64 %), 43 (0,15 %), 44 (2,06 %), 46 (0,003 %), 48 (0,185 %). Elektronische Struktur des Calciumatoms: 1s2, 2s2p6, 3s2p6, 4s2. Der Radius des Atoms beträgt 1,97 A, der Radius des Ions 1,06 A. Bis 300 ° haben Calciumkristalle die Form eines Würfels mit zentrierten Flächen und einer Seitengröße von 5,53 A, über 450 ° - eine sechseckige Form. Spezifisches Gewicht Calcium 1,542, Schmelzpunkt 851°, Siedepunkt 1487°, Schmelzwärme 2,23 kcal/mol, Verdampfungswärme 36,58 kcal/mol. Atomare Wärmekapazität von festem Calcium Cp = 5,24 + 3,50*10v-3 T für 298-673°K und Cp = 6,29+1,40*10v-3T für 673-1124°K; für flüssiges Calcium Cp = 7,63. Entropie von festem Calcium 9,95 ± 1, gasförmig bei 25° 37,00 ± 0,01.
Der Dampfdruck von festem Calcium wurde von Yu.A. Priselkov und A.N. Nesmeyanov, P. Douglas und D. Tomlin. Die Elastizitätswerte von gesättigtem Calciumdampf sind in der Tabelle angegeben. eins.
In Bezug auf die Wärmeleitfähigkeit nähert sich Calcium Natrium und Kalium an, bei Temperaturen von 20-100 ° beträgt der lineare Ausdehnungskoeffizient 25 * 10v-6, bei 20 ° beträgt der spezifische elektrische Widerstand 3,43 μ Ohm / cm3, von 0 bis 100 ° die Temperaturkoeffizient des elektrischen Widerstands beträgt 0,0036. Elektrochemisches Äquivalent 0,74745 g/a*h. Zugfestigkeit von Calcium 4,4 kg/mm2, Brinellhärte 13, Dehnung 53 %, Reduktionsverhältnis 62 %.
Calcium hat eine silbrig-weiße Farbe, glitzert, wenn es gebrochen ist. An der Luft ist das Metall mit einem dünnen bläulich-grauen Film aus Nitrid, Oxid und teilweise Calciumperoxid bedeckt. Calcium ist flexibel und formbar; es kann verarbeitet werden Drehbank B. Bohren, Schneiden, Sägen, Pressen, Ziehen etc. Je reiner das Metall, desto duktiler ist es.
In einer Reihe von Spannungen gehört Calcium zu den elektronegativsten Metallen, was seine hohe chemische Aktivität erklärt. Bei Raumtemperatur reagiert Calcium nicht mit trockener Luft, ab 300 ° wird es intensiv oxidiert und brennt bei starker Erwärmung mit einer leuchtend orange-rötlichen Flamme. In feuchter Luft wird Kalzium allmählich oxidiert und verwandelt sich in Hydroxid; Mit kaltes Wasser reagiert relativ träge, aber heißes Wasser verdrängt energisch Wasserstoff und bildet Hydroxid.
Stickstoff reagiert deutlich mit Calcium bei 300° und sehr intensiv bei 900°, um das Nitrid Ca3N2 zu bilden. Mit Wasserstoff bei einer Temperatur von 400° bildet Calcium das Hydrid CaH2. Mit trockenen Halogenen, mit Ausnahme von Fluor, bindet Calcium bei Raumtemperatur nicht; ab 400° kommt es zu intensiver Halogenidbildung.
Starke Schwefelsäure (65-60 ° Be) und Salpetersäure wirken schwach auf reines Calcium. Von wässrige Lösungen Salzsäure, starke Salpetersäure und schwache Schwefelsäure wirken sehr stark auf Mineralsäuren. In konzentrierten NaOH-Lösungen und in Sodalösungen wird Calcium fast nicht zerstört.
Anwendung
Calcium wird zunehmend in verwendet verschiedene Branchen Produktion. v In letzter Zeit er erwarb sehr wichtig als Reduktionsmittel bei der Herstellung einer Reihe von Metallen. Reines Uranmetall wird durch Reduktion von Uranfluorid mit Calciummetall erhalten. Titanoxide sowie Oxide von Zirkonium, Thorium, Tantal, Niob und anderen seltenen Metallen können mit Calcium oder seinen Hydriden reduziert werden. Calcium ist ein guter Desoxidator und Entgaser bei der Herstellung von Kupfer, Nickel, Chrom-Nickel-Legierungen, Spezialstählen, Nickel- und Zinnbronzen; es entfernt Schwefel, Phosphor und Kohlenstoff aus Metallen und Legierungen.
Calcium bildet mit Wismut feuerfeste Verbindungen, daher wird es zur Reinigung von Blei aus Wismut verwendet.
Calcium wird verschiedenen Leichtmetallen zugesetzt. Es trägt zur Verbesserung der Barrenoberfläche, Feinheit und Verringerung der Oxidierbarkeit bei. Calciumhaltige Lagerlegierungen sind weit verbreitet. Bleilegierungen (0,04 % Ca) können zur Herstellung von Kabelmänteln verwendet werden.
Calcium wird zur Dehydratisierung von Alkoholen und Lösungsmitteln zur Entschwefelung von Erdölprodukten verwendet. Zur Herstellung von hochwertigem Porenbeton werden Calcium-Zink-Legierungen oder Zink-Magnesium-Legierungen (70 % Ca) verwendet. Kalzium ist ein Bestandteil von Gleitlegierungen (Blei-Kalzium-Babbits).
Aufgrund der Fähigkeit, Sauerstoff und Stickstoff zu binden, werden Calcium oder Calciumlegierungen mit Natrium und anderen Metallen zur Reinigung verwendet Edelgase und als Getter in Vakuumfunkgeräten. Calcium wird auch zur Herstellung von Hydrid verwendet, das eine Wasserstoffquelle darstellt Feldbedingungen. Calcium bildet mit Kohlenstoff Calciumcarbid CaC2, das in verwendet wird große Mengen um Acetylen C2H2 zu erhalten.
Die Entwicklungsgeschichte
Devi erhielt erstmals 1808 Kalzium in Form eines Amalgams durch Elektrolyse von feuchtem Kalk mit einer Quecksilberkathode. Bunsen erhielt 1852 durch Elektrolyse einer salzsauren Lösung von Calciumchlorid ein Amalgam mit hohem Calciumgehalt. Bunsen und Mathyssen erhielten 1855 reines Calcium durch Elektrolyse von CaCl2 und Moissan durch Elektrolyse von CaF2. 1893 verbesserte Borchers die Elektrolyse von Calciumchlorid durch Kathodenkühlung erheblich; Arndt erhielt 1902 durch Elektrolyse ein Metall mit 91,3 % Ca. Ruff und Plata verwendeten eine Mischung aus CaCl2 und CaF2, um die Elektrolysetemperatur zu senken; Borchers und Stockem erhielten einen Schwamm bei einer Temperatur unterhalb des Schmelzpunktes von Calcium.
Rathenau und Süter lösten das Problem der elektrolytischen Herstellung von Calcium, indem sie ein Elektrolyseverfahren mit einer Berührungskathode vorschlugen, das bald industriell wurde. Es gab viele Vorschläge und Versuche, Calciumlegierungen durch Elektrolyse, insbesondere an einer flüssigen Kathode, zu erhalten. Laut F. O. Banzel ist es möglich, Calciumlegierungen durch Elektrolyse von CaF2 unter Zusatz von Salzen oder Fluoroxiden anderer Metalle zu erhalten. Poulenet und Melan erhielten eine Ca-Al-Legierung auf einer flüssigen Aluminiumkathode; Kugelgen und Seward stellten eine Ca-Zn-Legierung auf einer Zinkkathode her. Die Herstellung von Ca-Zn-Legierungen wurde 1913 von V. Moldengauer und J. Andersen untersucht, die auch Pb-Ca-Legierungen an einer Bleikathode erhielten. Koba, Simkins und Gire verwendeten eine 2000-A-Bleikathodenzelle und stellten eine Legierung mit 2 % Ca bei einer Stromausbeute von 20 % her. I. Tselikov und V. Wazinger fügten dem Elektrolyten NaCl hinzu, um eine Legierung mit Natrium zu erhalten; R.R. Syromyatnikov rührte die Legierung und erreichte eine Stromausbeute von 40–68 %. Calciumlegierungen mit Blei, Zink und Kupfer werden im industriellen Maßstab durch Elektrolyse hergestellt.
Das thermische Verfahren zur Gewinnung von Calcium hat großes Interesse geweckt. Die aluminothermische Reduktion von Oxiden wurde 1865 von H.H. Beketov. 1877 entdeckte Malet die Wechselwirkung einer Mischung aus Calcium-, Barium- und Strontiumoxiden mit Aluminium beim Erhitzen Winkler versuchte, dieselben Oxide mit Magnesium zu reduzieren; Bilz und Wagner, die Calciumoxid im Vakuum mit Aluminium reduzierten, erzielten eine geringe Ausbeute an Metall, die Gunz 1929 erreichte Beste Ergebnisse. KI Voinitsky reduzierte 1938 Calciumoxid mit Aluminium- und Siliziumlegierungen im Labor. Das Verfahren wurde 1938 patentiert. Am Ende des Zweiten Weltkriegs wurde das thermische Verfahren industriell eingesetzt.
1859 schlug Caron ein Verfahren vor, um Legierungen von Natrium mit Erdalkalimetallen durch Einwirkung von metallischem Natrium auf ihre Chloride zu erhalten. Nach dieser Methode wird Calcium (und Barin) in einer Legierung mit Blei gewonnen.Bis zum Zweiten Weltkrieg industrielle Produktion Calciumelektrolyse wurde nach Deutschland und Fraktion geliefert. In Biterfeld (Deutschland) wurden im Zeitraum von 1934 bis 1939 jährlich 5-10 Tonnen Calcium produziert, der US-Bedarf an Calcium wurde durch Importe gedeckt, die sich im Zeitraum 1920-1940 auf 10-25 g pro Jahr beliefen. Seit 1940, als die Einfuhren aus Frankreich eingestellt wurden, begannen die Vereinigten Staaten, Kalzium in beträchtlichen Mengen selbst durch Elektrolyse herzustellen; am Ende des Krieges begannen sie, Kalzium durch vakuumthermische Methode zu erhalten; Laut S. Loomis erreichte die Leistung 4,5 Tonnen pro Tag. Laut Minerale Yarbuk produzierte Dominium Magnesium in Kanada pro Jahr Kalzium:
Angaben zum Ausmaß der Calciumfreisetzung z letzten Jahren fehlen.
27.03.2019
Zunächst müssen Sie entscheiden, wie viel Sie bereit sind, für den Kauf auszugeben. Experten empfehlen Anfängern einen Betrag von 30.000 bis 100 Rubel. Es lohnt sich ...
27.03.2019
Metallwalzen wird in unserer Zeit in einer Vielzahl von Situationen aktiv eingesetzt. Tatsächlich ist es in vielen Branchen einfach unmöglich, darauf zu verzichten, da gewalztes Metall ...
27.03.2019
Stahldichtungen mit ovalem Querschnitt sind zum Abdichten von Flanschverbindungen von Armaturen und Rohrleitungen bestimmt, die aggressive Medien transportieren....
26.03.2019
Viele von uns haben von einer solchen Position als Systemadministrator gehört, aber nicht jeder kann sich vorstellen, was genau mit diesem Ausdruck gemeint ist....
26.03.2019
Jeder, der Reparaturen in seinem Zimmer durchführt, sollte sich überlegen, welche Strukturen im Innenraum installiert werden müssen. Auf dem Markt...
26.03.2019
26.03.2019
Bis heute werden Gasanalysatoren aktiv in der Öl- und Gasindustrie, im kommunalen Bereich, im Rahmen der Analyse in Laborkomplexen, für...
Kalzium ich
Kalzium (Kalzium, Ca)
chemisches Element der Gruppe II des Periodensystems der chemischen Elemente D.I. Mendelejew; bezieht sich auf Erdalkalimetalle, hat eine hohe biologische Aktivität. Die Ordnungszahl von Calcium ist 20, die Atommasse 40,08. In der Natur wurden sechs stabile Isotope von K mit den Massenzahlen 40, 42, 43, 44, 46 und 48 gefunden. Calcium ist chemisch aktiv und kommt in der Natur in Form von Verbindungen vor - Silikaten (z. B. Asbest), Carbonaten (Kalkstein, Marmor, Kreide, Calcit, Aragonit), Sulfaten (Gips und Anhydrit), Phosphorit, Dolomit usw. Es ist das Hauptstrukturelement des Knochengewebes (siehe Knochen) ,
ein wichtiger Bestandteil des Blutgerinnungssystems (Blutgerinnung) ,
ein wesentliches Element der menschlichen Nahrung, das ein homöostatisches Verhältnis von Elektrolyten aufrechterhält interne Umgebung Organismus. Zu den wichtigsten Funktionen in einem lebenden Organismus gehört seine Beteiligung an der Arbeit vieler Enzymsysteme (einschließlich der Bereitstellung von Muskeln) bei der Übertragung eines Nervenimpulses, bei der Reaktion von Muskeln auf einen Nervenimpuls und bei Änderungen der Hormonaktivität, die wird unter Beteiligung der Adenylatcyclase realisiert. Der menschliche Körper enthält 1-2 kg Kalzium (ca. 20 g für 1 kg Körpergewicht, bei Neugeborenen etwa 9 g/kg). Von der Gesamtmenge an Kalzium sind 98-99% in der Zusammensetzung von Knochen- und Knorpelgeweben in Form von Carbonat, Phosphat, Verbindungen mit Chlor, organischen Säuren und anderen Substanzen enthalten. Der Rest verteilt sich auf Weichteile (ca. 20 mg pro 100 g Gewebe) und extrazelluläre Flüssigkeit. Das Blutplasma enthält etwa 2,5 mmol/l Kalzium (9-11 mg/100 ml) in Form von zwei Fraktionen: nicht diffundierend (Komplexe mit Proteinen) und diffundierend (ionisiertes K. und Komplexe mit Säuren). Komplexe mit Proteinen sind eine der Formen der Calciumablagerung. Sie machen 1/3 der Gesamtmenge an K.-Plasma aus. ionisiertes K im Blut beträgt 1,33 mmol/l, Komplexe mit Phosphaten, Carbonaten, Citraten und Anionen anderer organischer Säuren - 0,3 mmol/l. Es besteht eine umgekehrte Beziehung zwischen ionisiertem K. und K.-Phosphat im Blutplasma, jedoch wird bei Rachitis eine Abnahme der Konzentration beider Ionen und bei Hyperparathyreoidismus eine Zunahme beobachtet. In Zellen ist der Hauptteil von K. mit Proteinen und Phospholipiden assoziiert Zellmembranen und Membranen von Zellorganellen. Die Regulation des transmembranösen Ca 2+ -Transfers, an dem bestimmte Ca 2+ -abhängige beteiligt sind, erfolgt durch die Hormone der Schilddrüse (Thyroid gland) und der Nebenschilddrüsen (Parathyroid glands) -
Parathormon und sein Antagonist Calcitonin. Der Gehalt an ionisiertem K. im Plasma wird durch einen komplexen Mechanismus reguliert, dessen Bestandteile (Depot K.), Leber (mit Galle) und Calcitonin sowie D (1,25-Dioxycholecalciferol) sind. erhöht den Gehalt an K. und reduziert den Gehalt an K.-Phosphat im Blut und wirkt synergistisch mit Vitamin D. Es verursacht Hyperkalzämie, indem es die Aktivität von Osteoklasten erhöht und die Resorption verstärkt, die Reabsorption von K. in den Nierentubuli erhöht. Bei Hypokalzämie steigt das Parathormon signifikant an. , ein Parathormonantagonist, mit Hyperkalzämie reduziert den Gehalt an K. im Blut und die Anzahl der Osteoklasten, erhöht die Ausscheidung von K.-Phosphat durch die Nieren. Die Hypophyse ist auch an der Regulation des Stoffwechsels beteiligt K. (siehe Hypophysenhormone) ,
Nebennierenrinde (Nebennieren) .
Die Aufrechterhaltung der homöostatischen Konzentration von K. im Körper wird vom Zentralnervensystem koordiniert. (hauptsächlich das Hypothalamus-Hypophysen-System (Hypothalamus-Hypophysen-System)) und das vegetative Nervensystem. K. gehört wichtige Rolle im Mechanismus der Muskelarbeit (Muskelarbeit) .
Es ist ein Faktor, der die Muskelkontraktion ermöglicht: Mit einer Erhöhung der Konzentration von K.-Ionen im Myoplasma bindet K. an das regulatorische Protein, wodurch es in der Lage ist, mit Myosin zu interagieren; Durch die Verbindung bilden sich diese beiden Proteine und der Muskel zieht sich zusammen. Bei der Bildung von Actomyosin entsteht ATP, dessen chemische Energie die Leistung mechanischer Arbeit erbringt und teilweise in Form von Wärme abgeführt wird. Das größte kontraktile Skelett wird bei einer Calciumkonzentration von 10 –6 –10 –7 beobachtet Maulwurf; mit einer Abnahme der Konzentration von K.-Ionen (weniger als 10 -7 Maulwurf) Muskel verliert die Fähigkeit, sich zu verkürzen und zu spannen. Die Wirkung von K. auf Gewebe äußert sich in einer Veränderung ihres Trophismus, der Intensität von Redoxprozessen und in anderen Reaktionen, die mit der Energiebildung verbunden sind. Eine Änderung der K.-Konzentration in der die Nervenzelle umgebenden Flüssigkeit beeinflusst ihre Membranen für Kaliumionen und insbesondere für Natriumionen erheblich (siehe Biologische Membranen). ,
Darüber hinaus bewirkt eine Abnahme des K.-Spiegels eine Erhöhung der Permeabilität der Membran für Natriumionen und eine Erhöhung der Erregbarkeit des Neurons. Die Erhöhung der K.-Konzentration wirkt stabilisierend auf die Membran der Nervenzelle. Die Rolle von K. in den Prozessen, die mit der Synthese und Freisetzung von Mediatoren durch die Nervenenden (Mediatoren) verbunden sind, wurde festgestellt. ,
bietet synaptische Übertragung von Nervenimpulsen. Die Quelle von K. für den Körper sind. Ein Erwachsener sollte 800-1100 pro Tag mit Nahrung erhalten. mg Kalzium, Kinder unter 7 Jahren - etwa 1000 mg, 14-18 Jahre alt - 1400 mg, schwangere Frauen - 1500 mg, Krankenpflege - 1800-2000 mg. In Lebensmitteln enthaltenes Calcium wird hauptsächlich durch Phosphat, andere Verbindungen (Carbonat, Tartrat, K. Oxalat und Calcium-Magnesium-Salz der Phytinsäure) dargestellt - in viel geringeren Mengen. Vorwiegend unlösliche Salze K. im Magen werden durch Magensaft teilweise gelöst, dann werden sie der Einwirkung von Gallensäuren ausgesetzt, die sie in eine assimilierte Form umwandeln. To findet hauptsächlich in den proximalen Abteilungen des Dünndarmes statt. ein Erwachsener nimmt weniger als die Hälfte der mit der Nahrung aufgenommenen Gesamtmenge an K. Die Aufnahme von K. nimmt während des Wachstums während der Schwangerschaft und Laktation zu. Die Assimilation von K. wird durch sein Verhältnis mit Fetten, Magnesium und Phosphor der Nahrung, Vitamin D und anderen Faktoren beeinflusst. Bei unzureichender Fettaufnahme entsteht ein Mangel an Calciumfettsäuresalzen, die für die Bildung löslicher Komplexe mit Gallensäuren notwendig sind. Umgekehrt sind beim Verzehr von übermäßig fetthaltigen Lebensmitteln nicht genügend Gallensäuren vorhanden, um sie in einen löslichen Zustand umzuwandeln, sodass eine erhebliche Menge an nicht absorbiertem Kalzium aus dem Körper ausgeschieden wird. Das optimale Verhältnis von K. und Phosphor in Lebensmitteln sorgt für die Mineralisierung der Knochen eines wachsenden Organismus. Der Regulator dieses Verhältnisses ist Vitamin D, was den erhöhten Bedarf bei Kindern erklärt. Die Art der Ausscheidung von K. hängt von der Art der Ernährung ab: Bei vorherrschenden sauren Produkten in der Ernährung (Fleisch, Brot, Getreidegerichte) steigt die Ausscheidung von K. mit Urin und Produkten mit alkalischer Reaktion (Milchprodukte, Obst, Gemüse) - mit Kot. Bereits eine geringfügige Erhöhung des Gehalts im Blut führt zu einer erhöhten Ausscheidung von K. mit dem Urin. Überschuss () K. oder Mangel () davon im Körper kann die Ursache oder Folge einer Reihe von pathologischen Zuständen sein. Hyperkalzämie tritt also bei übermäßiger Einnahme von Salzen K., erhöhter Aufnahme von K. im Darm, einer Abnahme seiner Ausscheidung durch die Nieren, erhöhtem Verbrauch von Vitamin D auf und äußert sich in Wachstumsverzögerung, Anorexie, Verstopfung, Durst, Polyurie , Muskelhypotonie, Hyperreflexie. Längere Hyperkalzämie entwickelt Verkalkung ,
arteriell, Nephropathie. beobachtet bei einer Reihe von Krankheiten, die mit einer Verletzung des Mineralstoffwechsels einhergehen (siehe Rachitis ,
Osteomalazie) ,
systemische Knochensarkoidose und multiples Myelom, Itsenko-Cushing-Krankheit, Akromegalie, Hypothyreose, bösartige Tumore, insbesondere bei Vorhandensein von Knochenmetastasen, Hyperparathyreoidismus. Eine Hyperkalzämie wird normalerweise begleitet. Hypokalzämie, die sich klinisch als Tetanie (Tetanie) manifestiert ,
kann bei Hypoparathyreoidismus, idiopathischer Tetanie (Spasmophilie), Erkrankungen des Gastrointestinaltrakts, chronischem Nierenversagen, Diabetes mellitus, Fanconi-Albertini-Syndrom, Hypovitaminose D auftreten. Bei einem Mangel an K. im Körper werden K-Präparate zur Ersatztherapie eingesetzt. (Calciumchlorid, Calciumgluconat, Calciumlactat, Calcium, Calciumcarbonat). Die Bestimmung des K.-Gehalts in Blutserum, Urin und Kot dient als diagnostischer Hilfstest für bestimmte Krankheiten. Zur Untersuchung biologischer Flüssigkeiten werden direkte und indirekte Methoden verwendet. Indirekte Methoden beruhen auf einer Vorfällung von K. mit Ammoniumoxalat, Chloranilat oder Pikrolenat und anschließender gravimetrischer, titrimetrischer oder kolorimetrischer Bestimmung. Zu den direkten Verfahren gehören die komplexometrische Titration in Gegenwart von Ethylendiamintetraacetat oder Ethylenglycoltetraacetat und Metallindikatoren wie Murexid (Greenblatt-Hartman-Verfahren), Fluorexon, saures Chrom, Dunkelblau, Calcium usw., kolorimetrische Verfahren unter Verwendung von Alizarin, Methylthymolblau, o-Cresolphthalein Komplexon, Glookeal-bis-2-hydroxyanyl; fluorimetrische Methoden flammenphotometrische Methode; Atomabsorptionsspektrometrie (die genaueste und empfindlichste Methode, mit der Sie bis zu 0,0001 % Calcium bestimmen können); Methode mit ionenselektiven Elektroden (ermöglicht die Bestimmung der Aktivität von Calciumionen). Der Gehalt an ionisiertem K. im Blutserum kann anhand der Daten) der Konzentration von Gesamt-K. und Gesamtprotein mit der empirischen Formel bestimmt werden: Prozentsatz des an Protein gebundenen Calciums = 8 () + 2 () + 3 g/100 ml. Literaturverzeichnis: Kostjuk P.G. Calcium and zellulär, M., 1986, Bibliogr.; Laborforschungsmethoden in der Klinik, hg. VV Menschikow, p. 59, 265, M., 1987; Regulation und Calciumionen, hrsg. MD Kursky et al., Kiew, 1977; Romanenko V.D. Kalziumstoffwechsel, Kiew, 1975, Bibliogr. chemisches Element der Gruppe II des Periodensystems D.I. Mendelejew; Ordnungszahl 20, Atommasse 40,08; hat eine hohe biologische Aktivität; ist ein wichtiger Bestandteil des Blutgerinnungssystems; ist Teil des Knochengewebes; Als Arzneimittel werden verschiedene Calciumverbindungen verwendet.
1. Kleine medizinische Enzyklopädie. - M.: Medizinische Enzyklopädie. 1991-96 2. Zuerst Gesundheitsvorsorge. - M.: Große Russische Enzyklopädie. 1994 3. Enzyklopädisches Wörterbuch medizinische Begriffe. - M.: Sowjetische Enzyklopädie. - 1982-1984.
Synonyme:- (Calcium), Ca, chemisches Element der Gruppe II des Periodensystems, Ordnungszahl 20, Atommasse 40,08; bezieht sich auf Erdalkalimetalle; MP 842shC. Enthalten im Knochengewebe von Wirbeltieren, Schalen von Weichtieren, Eierschalen. Kalzium ... ... Moderne Enzyklopädie
Das Metall ist silbrig weiß, zähflüssig, formbar und oxidiert schnell an der Luft. Schmelzrate pa 800 810°. In der Natur kommt es in Form verschiedener Salze vor, die Ablagerungen von Kreide, Kalkstein, Marmor, Phosphoriten, Apatiten, Gips usw. auf dem Gelb bilden. dor… … Technisches Eisenbahnlexikon
- (lat. Calcium) Ca, ein chemisches Element der Gruppe II des Periodensystems, Ordnungszahl 20, Atommasse 40,078, gehört zu den Erdalkalimetallen. Der Name leitet sich vom lateinischen calx ab, Genitiv calcis lime. Silberweißes Metall, ... ... Großes enzyklopädisches Wörterbuch
- (Symbol Ca), ein weit verbreitetes silbrig-weißes Metall aus der Gruppe der ERDALKALIEN, wurde erstmals 1808 isoliert. Es findet sich in vielen Gesteinen und Mineralien, insbesondere in Kalkstein und Gips, sowie in Knochen. Trägt zum Körper bei... Wissenschaftliches und technisches Lexikon
Ca (von lat. Calx, Gattung calcis lime *a. calcium; n. Kalzium; f. calcium; and. calcio), chem. Element II Gruppe periodisch. Systeme von Mendelejew, at.s. 20, bei. M. 40.08. Es besteht aus sechs stabilen Isotopen: 40Ca (96,97%), 42Ca (0,64%), ... ... Geologische Enzyklopädie
KALZIUM, Kalzium, pl. kein Ehemann. (von lat. Kalkkalk) (chemisch). Das chemische Element ist ein silbrig-weißes Metall, das in Kalk vorkommt. Wörterbuch Uschakow. DN Uschakow. 1935 1940 ... Erklärendes Wörterbuch Uschakow Physikalische Enzyklopädie
Einführung
Eigenschaften und Verwendung von Calcium
3 Anwendung
Kalzium bekommen
1 Elektrolytische Herstellung von Calcium und seinen Legierungen
2 Thermische Aufbereitung
3 Vakuumthermisches Verfahren zur Gewinnung von Calcium
3.1 Aluminothermisches Verfahren zur Calciumreduktion
3.2 Silicothermisches Verfahren zur Calciumreduktion
Praktischer Teil
Literaturverzeichnis
Einführung
Chemisches Element der Gruppe II des Periodensystems von Mendelejew, Ordnungszahl 20, Atommasse 40,08; silberweißes Leichtmetall. Ein natürliches Element ist eine Mischung aus sechs stabilen Isotopen: 40Ca, 42Ca, 43Ca, 44Ca, 46Ca und 48Ca, von denen 40 am häufigsten vorkommt Ca (96,97 %).
Ca-Verbindungen - Kalkstein, Marmor, Gips (sowie Kalk - ein Produkt des Brennens von Kalkstein) werden seit der Antike im Bauwesen verwendet. Bis zum Ende des 18. Jahrhunderts betrachteten Chemiker Kalk als eine einfache Substanz. 1789 schlug A. Lavoisier vor, dass Kalk, Magnesia, Schwerspat, Tonerde und Kieselerde komplexe Substanzen sind. Im Jahr 1808 unterzog G. Davy eine Mischung aus nassem gelöschtem Kalk mit Quecksilberoxid einer Elektrolyse mit einer Quecksilberkathode, stellte ein Amalgam von Ca her und nachdem er Quecksilber daraus getrieben hatte, erhielt er ein Metall namens "Calcium" (vom lateinischen calx , Gattung Case calcis - Kalk).
Die Fähigkeit von Calcium, Sauerstoff und Stickstoff zu binden, ermöglichte die Verwendung zur Reinigung von Inertgasen und als Getter (Ein Getter ist eine Substanz, die dazu dient, Gase zu absorbieren und in elektronischen Geräten ein tiefes Vakuum zu erzeugen.) in Vakuumfunkgeräten.
Calcium wird auch in der Metallurgie von Kupfer, Nickel, Edelstählen und Bronzen verwendet; Sie sind mit schädlichen Verunreinigungen von Schwefel, Phosphor und überschüssigem Kohlenstoff verbunden. Für die gleichen Zwecke werden Calciumlegierungen mit Silizium, Lithium, Natrium, Bor und Aluminium verwendet.
In der Industrie wird Calcium auf zwei Wegen gewonnen:
) Durch Erhitzen einer brikettierten Mischung aus CaO und Al-Pulver auf 1200 °C in einem Vakuum von 0,01 - 0,02 mm. rt. Kunst.; freigesetzt durch die Reaktion:
CaO + 2Al = 3CaO Al2O3 + 3Ca
Calciumdampf kondensiert auf einer kalten Oberfläche.
) Durch Elektrolyse einer Schmelze aus CaCl2 und KCl mit einer flüssigen Kupfer-Calcium-Kathode wird eine Legierung aus Cu - Ca (65 % Ca) hergestellt, aus der Calcium bei einer Temperatur von 950 - 1000 ° C im Vakuum abdestilliert wird von 0,1 - 0,001 mmHg.
) Es wurde auch ein Verfahren zur Gewinnung von Calcium durch thermische Dissoziation von Calciumcarbid CaC2 entwickelt.
Calcium kommt in der Natur in Form verschiedener Verbindungen sehr häufig vor. In der Erdkruste nimmt es mit 3,25 % den fünften Platz ein und kommt am häufigsten in Form von Kalkstein CaCO vor 3, Dolomit CaCO 3MgCO 3, Gips CaSO 42H 2O, Phosphorit Ca 3(PO 4)2 und Flussspat CaF 2, ohne einen signifikanten Anteil an Kalzium in der Zusammensetzung von Silikatgesteinen zu zählen. Meerwasser enthält durchschnittlich 0,04 % (Gew.) Calcium.
In dieser Studienarbeit werden die Eigenschaften und Anwendung von Calcium sowie die Theorie und Technologie vakuumthermischer Verfahren zu seiner Herstellung untersucht.
. Eigenschaften und Verwendung von Calcium
.1 Physikalische Eigenschaften
Calcium ist ein silbrig weißes Metall, das jedoch an der Luft anläuft, da sich auf seiner Oberfläche ein Oxid bildet. Es ist ein duktiles Metall, das härter als Blei ist. Kristallzelle ?-Form Ca (stabil bei normaler Temperatur) kubisch flächenzentriert, a = 5,56 Å . Atomradius 1,97 Å , Ionenradius Ca 2+, 1,04Å . Dichte 1,54 g/cm 3(20 °C). Über 464 °C stabil hexagonal ?-bilden. Smp. 851 °C, Kp. 1482 °C; Temperaturkoeffizient der linearen Ausdehnung 22 10 -6 (0-300°C); Wärmeleitfähigkeit bei 20 °C 125,6 W/(m K) oder 0,3 cal/(cm s °C); spezifische Wärme (0-100 °C) 623,9 J/(kg K) oder 0,149 cal/(g °C); spezifischer elektrischer Widerstand bei 20 °C 4,6 10 -8Ohm m oder 4,6 10 -6 Ohm cm; Temperaturkoeffizient des elektrischen Widerstands 4,57 · 10-3 (20 °C). Elastizitätsmodul 26 Gn/m 2(2600 kgf/mm 2); Zugfestigkeit 60 MN/m 2(6kgf/mm 2); Streckgrenze 4 MN/m 2(0,4 kgf/mm 2), Streckgrenze 38 MN/m 2(3,8 kgf/mm 2); Dehnung 50 %; Brinellhärte 200-300 MN/m 2(20-30 kgf/mm 2). Calcium von ausreichend hoher Reinheit ist plastisch, gut gepresst, gewalzt und kann maschinell bearbeitet werden.
1.2 Chemische Eigenschaften
Calcium ist ein aktives Metall. Unter normalen Bedingungen interagiert es also leicht mit Luftsauerstoff und Halogenen:
Ca + O 2= 2 CaO (Kalziumoxid) (1)
Ca + Br 2= CaBr 2(Calciumbromid). (2)
Mit Wasserstoff, Stickstoff, Schwefel, Phosphor, Kohlenstoff und anderen Nichtmetallen reagiert Calcium beim Erhitzen:
Ca+H 2= CaH 2(Calciumhydrid) (3)
Ca + N 2= Ca 3n 2(Kalziumnitrid) (4)
Ca + S = CaS (Calciumsulfid) (5)
Ca + 2 P \u003d Ca 3R 2(Kalziumphosphid) (6)
Ca + 2 C \u003d CaC 2 (Calciumcarbid) (7)
Calcium interagiert langsam mit kaltem Wasser und sehr heftig mit heißem Wasser, wodurch eine starke Base Ca (OH) 2 entsteht :
Ca + 2 H 2O \u003d Ca (OH) 2 +H 2 (8)
Als energetisches Reduktionsmittel kann Calcium Oxiden und Halogeniden weniger aktiver Metalle Sauerstoff oder Halogene entziehen, hat also reduzierende Eigenschaften:
Ca + Nb 2O5 = CaO + 2 Nb; (9)
Ca + 2 NbCl 5= 5 CaCl2 + 2 Nb (10)
Calcium reagiert heftig mit Säuren unter Freisetzung von Wasserstoff, reagiert mit Halogenen, mit trockenem Wasserstoff zu CaH-Hydrid 2. Beim Erhitzen von Calcium mit Graphit entsteht CaC-Carbid 2. Calcium wird durch Elektrolyse von geschmolzenem CaCl gewonnen 2oder aluminothermische Reduktion im Vakuum:
6СаО + 2Al = 3Ca + 3CaO Al2 Ö 3 (11)
Reines Metall wird verwendet, um Cs-, Rb-, Cr-, V-, Zr-, Th-, U-Verbindungen zu Metallen für die Stahldesoxidation zu reduzieren.
1.3 Anwendung
Calcium wird zunehmend in verschiedenen Industrien eingesetzt. In letzter Zeit hat es als Reduktionsmittel bei der Herstellung einer Reihe von Metallen große Bedeutung erlangt.
Reines Metall. Uran wird durch Reduktion von Uranfluorid mit Calciummetall gewonnen. Titanoxide sowie Oxide von Zirkonium, Thorium, Tantal, Niob und anderen seltenen Metallen können mit Calcium oder seinen Hydriden reduziert werden.
Calcium ist ein guter Desoxidator und Entgaser bei der Herstellung von Kupfer, Nickel, Chrom-Nickel-Legierungen, Spezialstählen, Nickel- und Zinnbronzen; es entfernt Schwefel, Phosphor, Kohlenstoff aus Metallen und Legierungen.
Calcium bildet mit Wismut feuerfeste Verbindungen, daher wird es zur Reinigung von Blei aus Wismut verwendet.
Calcium wird verschiedenen Leichtmetallen zugesetzt. Es trägt zur Verbesserung der Barrenoberfläche, Feinheit und Verringerung der Oxidierbarkeit bei.
Calciumhaltige Lagerlegierungen sind weit verbreitet. Bleilegierungen (0,04 % Ca) können zur Herstellung von Kabelmänteln verwendet werden.
Wälzlegierungen von Calcium mit Blei werden in der Technik verwendet. Calciummineralien sind weit verbreitet. So findet Kalkstein Verwendung bei der Herstellung von Kalk, Zement, Kalksandstein und direkt als Baustoff, in der Metallurgie (Flux), in Chemieindustrie zur Herstellung von Calciumcarbid, Soda, Natronlauge, Bleichmittel, Düngemittel, bei der Zuckerherstellung, Glas.
Von praktischer Bedeutung sind Kreide, Marmor, Isländischer Spat, Gips, Fluorit usw. Aufgrund der Fähigkeit, Sauerstoff und Stickstoff zu binden, werden Calcium oder Calciumlegierungen mit Natrium und anderen Metallen zur Reinigung von Edelgasen und als Getter in Vakuumfunkgeräten verwendet. Calcium wird auch zur Herstellung von Hydrid verwendet, das auf dem Feld eine Wasserstoffquelle darstellt.
2. Kalzium bekommen
Es gibt mehrere Möglichkeiten, Kalzium zu gewinnen, diese sind elektrolytisch, thermisch, vakuumthermisch.
.1 Elektrolytische Herstellung von Calcium und seinen Legierungen
Das Wesen des Verfahrens liegt darin, dass die Kathode zunächst den geschmolzenen Elektrolyten berührt. An der Kontaktstelle entsteht ein die Kathode benetzender flüssiger Metalltropfen, der beim langsamen und gleichmäßigen Anheben der Kathode mit dieser aus der Schmelze entfernt wird und erstarrt. Dabei wird der erstarrende Tropfen mit einem festen Elektrolytfilm bedeckt, der das Metall vor Oxidation und Nitrierung schützt. Durch kontinuierliches und vorsichtiges Anheben der Kathode wird das Calcium in die Stäbe gezogen.
2.2 Thermische Aufbereitung
Calcium chemisch elektrolytisch thermisch
· Chloridverfahren: Die Technologie besteht aus dem Schmelzen und Dehydrieren von Calciumchlorid, dem Schmelzen von Blei, dem Erhalt einer doppelten Blei-Natrium-Legierung, dem Erhalt einer ternären Blei-Natrium-Calcium-Legierung und dem Verdünnen der ternären Legierung mit Blei nach dem Entfernen von Salzen. Die Reaktion mit Calciumchlorid verläuft gemäß Gleichung
CaCl 2 + Na 2Pb 5=2NaCl + PbCa + 2Pb (12)
· Carbide-Prozess: Die Grundlage für die Gewinnung einer Blei-Calcium-Legierung ist die Reaktion zwischen Calciumcarbid und geschmolzenem Blei gemäß der Gleichung
CaC 2+ 3Pb = Pb3 Ca+2C. (dreizehn)
2.3 Vakuumthermisches Verfahren zur Gewinnung von Calcium
Rohstoff für vakuumthermisches Verfahren
Ausgangsstoff für die thermische Reduktion von Calciumoxid ist Kalk, der durch Rösten von Kalkstein gewonnen wird. Die wichtigsten Anforderungen an Rohstoffe sind: Kalk muss möglichst rein sein und neben Calcium ein Minimum an reduzierbaren und in Metall umwandelbaren Verunreinigungen enthalten, insbesondere Alkalimetalle und Magnesium. Die Kalzinierung von Kalkstein sollte bis zur vollständigen Zersetzung des Karbonats durchgeführt werden, jedoch nicht vor dem Sintern, da die Reduzierbarkeit des Sintermaterials geringer ist. Das gebrannte Produkt muss vor Aufnahme von Feuchtigkeit und Kohlendioxid geschützt werden, deren Freisetzung während der Rückgewinnung die Leistung des Prozesses verringert. Die Technologie des Brennens von Kalkstein und der Verarbeitung des gebrannten Produkts ähnelt der Verarbeitung von Dolomit für das silicothermische Verfahren zur Gewinnung von Magnesium.
.3.1 Aluminothermisches Verfahren zur Calciumreduktion
Das Diagramm der Temperaturabhängigkeit der Änderung der freien Oxidationsenergie einer Reihe von Metallen (Abb. 1) zeigt, dass Calciumoxid eines der haltbarsten und am schwierigsten zu reduzierenden Oxide ist. Es kann von anderen Metallen nicht auf die übliche Weise - bei relativ niedriger Temperatur und atmosphärischem Druck - reduziert werden. Im Gegensatz dazu ist Calcium selbst ein ausgezeichnetes Reduktionsmittel für andere schwer zu reduzierende Verbindungen und ein Desoxidationsmittel für viele Metalle und Legierungen. Die Reduktion von Calciumoxid mit Kohlenstoff ist wegen der Bildung von Calciumcarbiden im Allgemeinen nicht möglich. Da Calcium jedoch einen relativ hohen Dampfdruck hat, kann sein Oxid je nach Reaktion im Vakuum mit Aluminium, Silizium oder deren Legierungen reduziert werden
CaO + ich? Ca + MeO (14).
Praktischer Nutzen Bisher hat er nur ein aluminothermisches Verfahren zur Gewinnung von Calcium gefunden, da sich CaO mit Aluminium viel einfacher reduzieren lässt als mit Silizium. Über die Chemie der Reduktion von Calciumoxid mit Aluminium gibt es unterschiedliche Ansichten. L. Pidgeon und I. Atkinson glauben, dass die Reaktion mit der Bildung von Calciummonoaluminat abläuft:
CaO + 2Al = CaOAl 2O3 + 3 Ca. (fünfzehn)
V. A. Pazukhin und A. Ya. Fisher weisen darauf hin, dass der Prozess mit der Bildung von Tricalciumaluminat abläuft:
CaO + 2Al = 3CaOAl 2O 3+ 3 Ca. (Sechszehn)
Laut A. I. Voynitsky überwiegt bei der Reaktion die Bildung von Pentacicium Triluminat:
CaO + 6Al = 5CaO 3Al 2O3 + 9Ca. (17)
Die neuesten Forschungen von A. Yu Taits und AI Voinitsky haben festgestellt, dass die aluminothermische Reduktion von Calcium schrittweise abläuft. Zunächst wird die Calciumfreisetzung von der Bildung von 3CaO AI begleitet 2Ö 3, das dann mit Calciumoxid und Aluminium zu 3CaO 3AI reagiert 2Ö 3. Die Reaktion verläuft nach folgendem Schema:
CaO + 6Al = 2 (3CaOAl 2Ö 3) + 2CaO + 2Al + 6Ca
(3CaOAl 2Ö 3) + 2CaO + 2Al = 5CaO 3Al 2O 3+ 3Са
CaO + 6A1 \u003d 5CaO 3Al 2O 3+ 9Ca
Da die Oxidreduktion unter Freisetzung von dampfförmigem Calcium erfolgt und die verbleibenden Reaktionsprodukte in einem kondensierten Zustand vorliegen, ist es möglich, sie leicht abzutrennen und in den gekühlten Abschnitten des Ofens zu kondensieren. Die Hauptvoraussetzungen für die vakuumthermische Reduktion von Calciumoxid sind hohe Temperatur und niedriger Restdruck im System. Die Beziehung zwischen Temperatur und dem Gleichgewichtsdampfdruck von Calcium ist unten angegeben. Die freie Energie der Reaktion (17), berechnet für Temperaturen von 1124–1728°K, wird ausgedrückt als
F T \u003d 184820 + 6,95 T-12,1 T lg T.
Daher die logarithmische Abhängigkeit der Gleichgewichtselastizität von Calciumdampf (mm Hg)
Lg p \u003d 3,59 - 4430 \ T.
L. Pidgeon und I. Atkinson bestimmten experimentell den Gleichgewichtsdampfdruck von Calcium. Eine detaillierte thermodynamische Analyse der Reduktionsreaktion von Calciumoxid mit Aluminium wurde von I. I. Matveenko durchgeführt, der die folgenden Temperaturabhängigkeiten des Gleichgewichtsdrucks von Calciumdampf angab:
lgp Ca(1) \u003d 8,64 - 12930\T mmHg
lgp Ca(2) \u003d 8,62 - 11780\T mmHg
lgp Ca (3 )\u003d 8,75 - 12500\T mmHg
Die berechneten und experimentellen Daten werden in der Tabelle verglichen. eins.
Tabelle 1 – Einfluss der Temperatur auf die Änderung der Gleichgewichtselastizität von Calciumdampf in den Systemen (1), (2), (3), (3), mm Hg.
Temperatur °С Experimentelle Daten Berechnet in Systemen(1)(2)(3)(3 )1401 1451 1500 1600 17000,791 1016 - - -0,37 0,55 1,2 3,9 11,01,7 3,2 5,6 18,2 492,7 3,5 4,4 6,6 9,50,66 1,4 2,5 8,5 25,7
Aus den vorgelegten Daten ist ersichtlich, dass die Wechselwirkungen in den Systemen (2) und (3) oder (3") unter den günstigsten Bedingungen stattfinden. Dies stimmt mit den Beobachtungen überein, da Pentascalciumtriluminat und Tricalciumaluminat in den Resten der Charge vorherrschen nach der Reduktion von Calciumoxid mit Aluminium.
Gleichgewichtselastizitätsdaten zeigen, dass die Reduktion von Calciumoxid mit Aluminium bei einer Temperatur von 1100-1150 ° C möglich ist. Um eine praktisch akzeptable Reaktionsgeschwindigkeit zu erreichen, muss der Restdruck im Rostsystem unter dem Gleichgewicht P liegen gleich , d. h. die Ungleichung Р gleich >S Ost , und das Verfahren muss bei Temperaturen in der Größenordnung von 1200° durchgeführt werden. Untersuchungen haben ergeben, dass bei einer Temperatur von 1200–1250° eine hohe Ausnutzung (bis zu 70–75 %) und ein geringer spezifischer Verbrauch an Aluminium (ca. 0,6–0,65 kg Calcium pro kg) erreicht wird.
Nach obiger Auslegung der Verfahrenschemie ist die optimale Zusammensetzung die für die Bildung von 5CaO 3Al im Rückstand ausgelegte Mischung 2Ö 3. Um den Verwendungsgrad von Aluminium zu erhöhen, ist es sinnvoll, einen gewissen Überschuss an Calciumoxid zu geben, jedoch nicht zu viel (10-20%), da dies sonst andere Prozessindikatoren beeinträchtigt. Mit einer Erhöhung des Aluminiummahlgrades von Partikeln von 0,8 bis 0,2 mm auf minus 0,07 mm (nach V. A. Pazukhin und A. Ya. Fisher) steigt die Verwendung von Aluminium in der Reaktion von 63,7 auf 78%.
Auch der Einsatz von Aluminium wird durch die Chargenart Brikettierung beeinflusst. Eine Mischung aus Kalk und Aluminiumpulver sollte ohne Bindemittel (um ein Ausgasen im Vakuum zu vermeiden) bei einem Druck von 150 kg/cm brikettiert werden 2. Bei niedrigeren Drücken nimmt die Verwendung von Aluminium aufgrund der Segregation von geschmolzenem Aluminium in übermäßig porösen Briketts und bei höheren Drücken aufgrund einer schlechten Gasdurchlässigkeit ab. Vollständigkeit und Geschwindigkeit der Rückgewinnung hängen auch von der Packungsdichte der Briketts in der Retorte ab. Bei lückenloser Verlegung, wenn die Gasdurchlässigkeit der gesamten Charge gering ist, wird der Einsatz von Aluminium deutlich reduziert.
Abbildung 2 - Schema zur Gewinnung von Calcium durch vakuumthermisches Verfahren.
Technologie des aluminothermischen Weges
Das technologische Schema zur Herstellung von Calcium nach dem aluminothermischen Verfahren ist in Abb. 1 dargestellt. 2. Als Rohstoff wird Kalkstein und als Reduktionsmittel Aluminiumpulver verwendet, das aus primärem (besserem) oder sekundärem Aluminium hergestellt wird. Als Reduktionsmittel verwendetes Aluminium sowie Rohstoffe sollten keine Verunreinigungen leicht flüchtiger Metalle enthalten: Magnesium, Zink, Alkalien usw., die verdampfen und sich in Kondensat umwandeln können. Dies muss bei der Auswahl von Recycling-Aluminium-Sorten berücksichtigt werden.
Nach der Beschreibung von S. Loomis und P. Staub wird in den USA im Werk der New England Lime Co. in Canaan (Connecticut) Calcium nach dem aluminothermischen Verfahren gewonnen. Es wird Kalk der folgenden typischen Zusammensetzung verwendet, %: 97,5 CaO, 0,65 MgO, 0,7 SiO 2, 0,6 Fe 2Unze + AlOz, 0,09 Na 2O+K 2Oh, 0,5 der Rest. Das kalzinierte Produkt wird in einer Raymond-Mühle mit Zentrifugalseparator gemahlen, die Mahlfeinheit beträgt (60 %) minus 200 Mesh. Als Reduktionsmittel wird Aluminiumstaub verwendet, der bei der Herstellung von Aluminiumpulver als Abfall anfällt. Branntkalk aus geschlossenen Trichtern und Aluminium aus Fässern werden der Dosierwaage und anschließend dem Mischer zugeführt. Nach dem Mischen wird die Mischung trocken brikettiert. In der genannten Anlage wird Calcium in Retortenöfen reduziert, die früher zur Gewinnung von Magnesium nach dem silicothermischen Verfahren eingesetzt wurden (Bild 3). Öfen werden mit Generatorgas beheizt. Jeder Ofen hat 20 horizontale Retorten aus feuerfestem Stahl mit 28 % Cr und 15 % Ni.
Abbildung 3 – Retortenofen für die Calciumproduktion
Retortenlänge 3 m, Durchmesser 254 mm, Wandstärke 28 mm. Die Reduktion erfolgt im beheizten Teil der Retorte, und die Kondensation erfolgt im gekühlten Ende, das aus der Rede herausragt. Die Briketts werden in Papiertüten in die Retorte eingebracht, dann werden die Kondensatoren eingesetzt und die Retorte verschlossen. Luft wird zu Beginn des Zyklus durch mechanische Vakuumpumpen abgepumpt. Dann werden die Diffusionspumpen angeschlossen und der Restdruck auf 20 Mikron reduziert.
Die Retorten werden auf 1200° aufgeheizt. Nach 12 Stunden. Nach dem Beladen werden die Retorten geöffnet und entladen. Das resultierende Calcium hat die Form eines Hohlzylinders aus einer dichten Masse großer Kristalle, die auf der Oberfläche einer Stahlhülse abgelagert sind. Die Hauptverunreinigung im Calcium ist Magnesium, das in erster Linie reduziert wird und sich hauptsächlich in der an die Hülse angrenzenden Schicht konzentriert. Der durchschnittliche Gehalt an Verunreinigungen beträgt; 0,5–1 % Mg, etwa 0,2 % Al, 0,005–0,02 % Mn, bis zu 0,02 % N, andere Verunreinigungen - Cu, Pb, Zn, Ni, Si, Fe – werden im Bereich von 0,005–0,04 % gefunden. A. Yu. Taits und AI Voinitsky verwendeten einen elektrischen Halbfabrik-Vakuumofen mit Kohleerhitzern, um Calcium nach dem aluminothermischen Verfahren zu erhalten, und erreichten einen Aluminiumausnutzungsgrad von 60 %, einen spezifischen Aluminiumverbrauch von 0,78 kg, einen spezifischen Chargenverbrauch von 4,35 kg und einem spezifischen Stromverbrauch von 14 kWh pro 1 kg Metall.
Das resultierende Metall zeichnete sich mit Ausnahme der Magnesiumverunreinigung durch eine relativ hohe Reinheit aus. Im Durchschnitt betrug der Gehalt an Verunreinigungen darin: 0,003–0,004 % Fe, 0,005–0,008 % Si, 0,04–0,15 % Mn, 0,0025–0,004 % Cu, 0,006–0,009 % N, 0,25 % Al.
2.3.2 Silicothermisches Reduktionsverfahren Kalzium
Das silicothermische Verfahren ist sehr verlockend; Das Reduktionsmittel ist Ferrosilizium, das Reagenz ist viel billiger als Aluminium. Allerdings ist das silicothermische Verfahren schwieriger durchzuführen als das aluminothermische. Die Reduktion von Calciumoxid durch Silizium verläuft nach der Gleichung
CaO + Si = 2CaOSiO2 + 2Ca. (achtzehn)
Die aus den Werten der freien Energie berechnete Gleichgewichtselastizität von Calciumdampf beträgt:
°С1300140015001600Р, mmHg st0.080.150.752.05
Daher in einem Vakuum in der Größenordnung von 0,01 mm Hg. Kunst. Die Reduktion von Calciumoxid ist thermodynamisch bei einer Temperatur von 1300° möglich. In der Praxis sollte das Verfahren zur Gewährleistung einer akzeptablen Geschwindigkeit bei einer Temperatur von 1400–1500°C durchgeführt werden.
Etwas einfacher verläuft die Reduktionsreaktion von Calciumoxid mit Siliciumaluminium, bei der sowohl Aluminium als auch Silicium der Legierung als Reduktionsmittel dienen. Experimentell wurde festgestellt, dass zu Beginn die Reduktion mit Aluminium überwiegt; außerdem läuft die Reaktion mit der endgültigen Bildung von bCaO 3Al ab 2Oz nach dem oben skizzierten Schema (Abb. 1). Die Siliziumreduktion wird bei höheren Temperaturen signifikant, wenn das meiste Aluminium reagiert hat; die Reaktion verläuft unter Bildung von 2CaO SiO 2. Zusammenfassend wird die Reduktionsreaktion von Calciumoxid mit Siliciumaluminium durch die folgende Gleichung ausgedrückt:
mSi + n Al + (4m +2 ?) CaO \u003d m (2CaO SiO 2) + ?n(5CaOAl 2O3 ) + (2m +1, 5n) Ca.
Untersuchungen von A. Yu Taits und A. I. Voinitsky ergaben, dass Calciumoxid durch 75% Ferrosilicium mit einer Metallausbeute von 50-75% bei einer Temperatur von 1400-1450 ° in einem Vakuum von 0,01-0,03 mm Hg reduziert wird. Kunst.; Siliziumaluminium mit 60–30 % Si und 32–58 % Al (der Rest ist Eisen, Titan usw.) reduziert Calciumoxid mit einer Metallausbeute von ungefähr 70 % bei Temperaturen von 1350–1400° in einem Vakuum von 0,01–0,05 mm Hg. Kunst. Versuche im halbtechnischen Maßstab bewiesen die grundsätzliche Möglichkeit, mit Ferrosilicium und Siliciumaluminium Calcium auf Kalk zu gewinnen. Die Hauptschwierigkeit der Hardware ist die Auswahl einer Auskleidung, die gegen diesen Prozess beständig ist.
Bei der Lösung dieses Problems kann das Verfahren in der Industrie implementiert werden. Abbau von Calciumcarbid Herstellung von metallischem Calcium durch Abbau von Calciumcarbid
CaC2 = Ca + 2C
sind als erfolgsversprechend anzusehen. In diesem Fall wird als zweites Produkt Graphit erhalten. W. Mauderly, E. Moser und W. Treadwell berechneten freie Energie Bildung von Calciumcarbid aus thermochemischen Daten erhalten wir folgenden Ausdruck für den Dampfdruck von Calcium gegenüber reinem Calciumcarbid:
ca \u003d 1,35 - 4505 \ T (1124 - 1712 ° K),
lgp ca \u003d 6,62 - 13523 \ T (1712-2000 ° K).
Offensichtlich zersetzt sich handelsübliches Calciumcarbid bei viel höheren Temperaturen als aus diesen Ausdrücken folgt. Dieselben Autoren berichten über die thermische Zersetzung von Calciumcarbid in kompakte Stücke bei 1600–1800°C in einem Vakuum von 1 mm Hg. Kunst. Die Ausbeute an Graphit betrug 94 %, Calcium wurde in Form einer dichten Beschichtung auf dem Kühlschrank erhalten. A. S. Mikulinsky, F. S. Morii, R. Sh. Shklyar Um die Eigenschaften von Graphit zu bestimmen, der durch die Zersetzung von Calciumcarbid erhalten wurde, wurde letzteres in einem Vakuum von 0,3-1 mm Hg erhitzt. Kunst. bei einer Temperatur von 1630-1750°. Der resultierende Graphit unterscheidet sich von dem von Acheson durch größere Körner, eine höhere elektrische Leitfähigkeit und eine geringere Schüttdichte.
3. Praktischer Teil
Der tägliche Magnesiumabfluss aus dem Elektrolyseur für einen Strom von 100 kA betrug 960 kg, wenn das Bad mit Magnesiumchlorid gespeist wurde. Die Spannung am Zellennarr beträgt 0,6 V. Ermitteln:
)Stromabgabe an der Kathode;
)Die pro Tag gewonnene Chlormenge, vorausgesetzt, dass die Stromabgabe an der Anode gleich der Stromabgabe am Kode ist;
)Tägliche Füllung MgCl 2in den Elektrolyseur, sofern der Verlust von MgCl 2 treten hauptsächlich bei Schlamm und Sublimation auf. Schlammmenge 0,1 pro 1 Tonne Mg mit MgCl 2 in Sublimation 50%. Die Sublimationsmenge beträgt 0,05 t pro 1 t Mg. Die Zusammensetzung des eingegossenen Magnesiumchlorids, %: 92 MgCl2 und 8 NaCl.
.Bestimmen Sie die Stromabgabe an der Kathode:
m etc = Ich k mg · ?
?=m etc \ICH ?k mg \u003d 960000\100000 0,454 24 \u003d 0,881 oder 88,1 %
.Bestimmen Sie die pro Tag aufgenommene Cl-Menge:
x \u003d 960000 g \ 24 g \ mol \u003d 40000 mol
Umrechnung auf Volumen:
х=126785,7 m3
3.a) Wir finden reines MgCl 2, für die Produktion von 960 kg Mg.
x \u003d 95 960 \ 24,3 \u003d 3753 kg \u003d 37,53 Tonnen.
b) Verluste mit Schlamm. Aus der Zusammensetzung von Magnesiumelektrolyseuren, %: 20-35 MgO, 2-5 Mg, 2-6 Fe, 2-4 SiO 2, 0,8-2 TiO 2, 0,4-1,0 C, 35 MgCl2 .
Kilogramm - 1000 Kilogramm
m schl \u003d 960 kg - Schlammmasse pro Tag.
Pro Tag 96 kg Schlamm: 96 0,35 (MgCl2 mit Schlamm).
c) Verluste mit Sublimaten:
Kilogramm - 1000 Kilogramm
kg Sublimate: 48 0,5 = 24 kg MgCl 2 mit Sublimaten.
Alles, was Sie brauchen, um Mg einzufüllen:
33,6+24=3810,6 kg MgCl2 pro Tag
Literaturverzeichnis
Grundlagen der Metallurgie III
<#"justify">Metallurgie von Al und Mg. Vetyukov M.M., Tsyplokov A.M.
Unterrichten
Benötigen Sie Hilfe beim Erlernen eines Themas?
Unsere Experten beraten oder bieten Nachhilfe zu Themen an, die Sie interessieren.
Einen Antrag stellen gleich das Thema angeben, um sich über die Möglichkeit einer Beratung zu informieren.