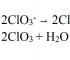Давсны гидролиз. Органик нэгдлүүдийн гидролиз
Хими нь ихэнх нарийн шинжлэх ухааны нэгэн адил маш их анхаарал, хатуу мэдлэг шаарддаг тул сургуулийн сурагчдын дуртай хичээл хэзээ ч байгаагүй. Мөн дэмий хоосон, учир нь түүний тусламжтайгаар хүний эргэн тойронд болон дотор болж буй олон үйл явцыг ойлгох боломжтой байдаг. Жишээлбэл, гидролизийн урвалыг авч үзье: эхлээд харахад энэ нь зөвхөн химийн эрдэмтдэд л хамаатай мэт боловч үнэн хэрэгтээ үүнгүйгээр ямар ч организм бүрэн ажиллах боломжгүй юм. Энэ үйл явцын онцлог, түүнчлэн түүний талаар олж мэдье практик ач холбогдолхүн төрөлхтний төлөө.
Гидролизийн урвал: энэ юу вэ?
Энэ хэллэг нь ус ба түүнд ууссан бодисын хоорондох солилцооны задралын өвөрмөц урвал бөгөөд шинэ нэгдлүүд үүсдэг. Гидролизийг мөн усан дахь солволиз гэж нэрлэж болно.
Энэхүү химийн нэр томъёо нь 2-оос гаралтай Грек үгс: "Ус" ба "задрал".
Гидролизийн бүтээгдэхүүн
H 2 O нь органик болон органик бус бодисуудтай харилцан үйлчлэх үед авч үзэж буй урвал үүсч болно. Үүний үр дүн нь ус юутай холбоотой байсан, мөн катализаторын нэмэлт бодис ашигласан эсэх, температур, даралт өөрчлөгдсөн эсэхээс шууд хамаарна.
Жишээлбэл, давсны гидролизийн урвал нь хүчил, шүлт үүсэхийг дэмждэг. Хэрвээ ирдэгорганик бодисын тухай, бусад бүтээгдэхүүнийг олж авдаг. Өөх тосыг усанд уусгах нь глицерин болон дээд өөхний хүчил үүсэхийг дэмждэг. Хэрэв процесс уурагтай явагддаг бол үр дүнд нь янз бүрийн амин хүчил үүсдэг. Нүүрс ус (полисахарид) нь моносахарид болж задардаг.
Уураг, нүүрс усыг бүрэн шингээх чадваргүй хүний биед гидролизийн урвал нь тэдгээрийг бие махбодид шингээх чадвартай бодис болгон "хялбаршуулдаг". Тиймээс усанд уусгах нь тоглодог чухал үүрэгБиологийн хувь хүн бүрийн хэвийн үйл ажиллагаанд.
Давсны гидролиз
Гидролизийг сурсны дараа органик бус гаралтай бодис, тухайлбал давс дахь түүний явцтай танилцах нь зүйтэй.
Энэ үйл явцын онцлог нь эдгээр нэгдлүүд устай харилцан үйлчлэх үед давсны найрлага дахь сул электролитийн ионууд түүнээс салж, H 2 O-тэй шинэ бодис үүсгэдэг. Энэ нь хүчил эсвэл хоёулаа байж болно. Энэ бүхний үр дүнд усны диссоциацийн тэнцвэрт өөрчлөлт гарч байна.

Эргэж болох ба эргэлт буцалтгүй гидролиз
Дээрх жишээн дээр, сүүлийнх нь нэг сумны оронд хоёр сумыг харж болно, хоёулаа өөр өөр чиглэлд чиглэнэ. Энэ нь юу гэсэн үг вэ? Энэ тэмдэг нь гидролизийн урвал буцах боломжтой болохыг харуулж байна. Практикт энэ нь устай харьцахдаа авсан бодис нь зөвхөн бүрэлдэхүүн хэсгүүдэд задардаг (шинэ нэгдлүүд үүсэх боломжийг олгодог) төдийгүй дахин үүсдэг гэсэн үг юм.

Гэсэн хэдий ч гидролиз бүр буцах боломжгүй, эс тэгвээс шинэ бодис тогтворгүй байх тул утгагүй болно.
Ийм хариу үйлдэл нь эргэлт буцалтгүй болоход нөлөөлж болох хэд хэдэн хүчин зүйл байдаг.
- Температур. Энэ нь өсөх эсвэл буурах эсэх нь үргэлжилж буй урвалын тэнцвэрт байдал ямар чиглэлд шилжихээс хамаарна. Хэрэв энэ нь өндөр байвал эндотермик урвал руу шилжих болно. Хэрэв эсрэгээр температур буурч байвал давуу тал нь экзотермик урвалын тал юм.
- Даралт. Энэ бол ионы гидролизд идэвхтэй нөлөөлдөг өөр нэг термодинамик хэмжигдэхүүн юм. Хэрэв энэ нь дээшлэх юм бол химийн тэнцвэрт байдал нь урвал руу шилждэг бөгөөд энэ нь хийн нийт хэмжээ буурахад дагалддаг. Хэрэв энэ нь буурвал эсрэгээрээ.
- Урвалд оролцож буй бодисын өндөр эсвэл бага концентраци, түүнчлэн нэмэлт катализатор байгаа эсэх.
Давсны уусмал дахь гидролизийн урвалын төрлүүд
- Анионоор (сөрөг цэнэгтэй ион). Сул ба хүчтэй суурийн хүчлүүдийн давсны усанд уусгах. Энэ урвал нь харилцан үйлчлэгч бодисуудын шинж чанараас шалтгаалан буцах боломжтой байдаг.


Гидролизийн зэрэг
Давс дахь гидролизийн шинж чанарыг судлахдаа түүний зэрэг гэх мэт үзэгдэлд анхаарлаа хандуулах нь зүйтэй. Энэ үг нь давсны (H 2 O-тай задралын урвалд орсон) уусмалд агуулагдах энэ бодисын нийт хэмжээтэй харьцуулсан харьцаа гэсэн үг юм.
Гидролизд оролцдог хүчил эсвэл суурь нь сул байх тусам түүний зэрэг нь өндөр байдаг. 0-100% -ийн хүрээнд хэмжигдэх ба доорх томьёогоор тодорхойлно.

N нь гидролизд орсон бодисын молекулуудын тоо, N 0 нь тэдгээрийн уусмал дахь нийт тоо юм.
Ихэнх тохиолдолд давс дахь усан уусмалын түвшин бага байдаг. Жишээлбэл, 1% натрийн ацетат уусмалд энэ нь зөвхөн 0.01% (20 градусын температурт) байна.
Органик бодис дахь гидролиз
Судалж буй процесс нь органик химийн нэгдлүүдэд ч тохиолдож болно.
Бараг бүх амьд организмд гидролиз нь энергийн солилцооны (катаболизм) нэг хэсэг болдог. Түүний тусламжтайгаар уураг, өөх тос, нүүрс усыг амархан шингэцтэй бодис болгон задалдаг. Үүний зэрэгцээ ус өөрөө солволизын процессыг эхлүүлэх нь ховор байдаг тул организм янз бүрийн ферментийг катализатор болгон ашиглах шаардлагатай болдог.
Хэрэв бид лабораторийн эсвэл үйлдвэрлэлийн нөхцөлд шинэ бодис олж авахад чиглэсэн органик бодисуудтай химийн урвалын талаар ярьж байгаа бол түүнийг хурдасгах, сайжруулахын тулд уусмалд хүчтэй хүчил эсвэл шүлтлэгийг нэмнэ.
Триглицерид (триацилглицерол) дахь гидролиз
Энэ хэлэх хэцүү нэр томъёо нь бидний ихэнх нь өөх тос гэж мэддэг өөх тосны хүчлийг хэлдэг.
Эдгээр нь амьтан, ургамлын гаралтай байдаг. Гэсэн хэдий ч ус ийм бодисыг уусгах чадваргүй гэдгийг хүн бүр мэддэг, өөхний гидролиз хэрхэн явагддаг вэ?

Энэ урвалыг өөх тосыг саванжуулах гэж нэрлэдэг. Энэ нь шүлтлэг эсвэл хүчиллэг орчинд ферментийн нөлөөн дор триацилглицеролуудын усан уусмал юм. Үүнээс хамааран шүлтлэг гидролиз ба хүчиллэг гидролиз ялгардаг.
Эхний тохиолдолд урвалын үр дүнд өндөр өөх тосны хүчлүүдийн давс (саван гэж хүн бүр мэддэг) үүсдэг. Тиймээс NaOH-аас энгийн хатуу саван, KOH-аас шингэн саван гаргаж авдаг. Тиймээс триглицерид дэх шүлтлэг гидролиз нь угаалгын нунтаг үүсгэх процесс юм. Үүнийг ургамлын болон амьтны гаралтай өөх тосоор чөлөөтэй хийж болно гэдгийг тэмдэглэх нь зүйтэй.

Саван нь хатуу усанд угаахад хэцүү, давстай усанд огт угаадаггүйтэй холбоотой хариу үйлдэл юм. Баримт нь H 2 O-ийг хатуу гэж нэрлэдэг бөгөөд энэ нь кальци, магнийн ионуудын илүүдэл агуулдаг. Саван нь усанд орсны дараа дахин гидролизд орж, натрийн ион болон нүүрсустөрөгчийн үлдэгдэлд задардаг. Усанд эдгээр бодисуудын харилцан үйлчлэлийн үр дүнд уусдаггүй давс үүсдэг бөгөөд энэ нь цагаан ширхэгтэй төстэй байдаг. Үүнээс урьдчилан сэргийлэхийн тулд натрийн бикарбонат NaHCO 3, илүү сайн мэддэг хужир... Энэ бодис нь уусмалын шүлтлэг чанарыг нэмэгдүүлж, улмаар саван нь үүргээ гүйцэтгэхэд тусалдаг. Дашрамд хэлэхэд, ийм бэрхшээлээс зайлсхийхийн тулд in орчин үеийн үйлдвэрлэлсинтетик болгох угаалгын нунтагбусад бодисоос, жишээлбэл, өндөр спирт, хүхрийн хүчлийн эфирийн давснаас. Тэдний молекулууд нь арван хоёроос арван дөрвөн нүүрстөрөгчийн атом агуулдаг тул давс, хатуу усанд шинж чанараа алддаггүй.
Хэрэв урвал явагдах орчин нь хүчиллэг байвал энэ процессыг триацилглицеролын хүчиллэг гидролиз гэж нэрлэдэг. Энэ тохиолдолд тодорхой хүчлийн нөлөөн дор бодисууд глицерин ба карбоксилын хүчил болж хувирдаг.
Өөх тосны гидролиз нь өөр нэг сонголттой байдаг - триацилглицеролыг устөрөгчжүүлэх. Энэ процессыг зарим төрлийн цэвэршүүлэхэд, жишээлбэл, этиленээс ацетилений ул мөрийг арилгах эсвэл янз бүрийн системээс хүчилтөрөгчийн хольцыг арилгахад ашигладаг.
Нүүрс усны гидролиз
Эдгээр бодисууд нь хүн, амьтны хоол хүнсний хамгийн чухал бүрэлдэхүүн хэсгүүдийн нэг юм. Гэсэн хэдий ч бие нь сахароз, лактоз, мальтоз, цардуул, гликогенийг цэвэр хэлбэрээр нь шингээх чадваргүй байдаг. Тиймээс өөх тосны хувьд эдгээр нүүрс ус нь гидролизийн урвалын тусламжтайгаар шингэцтэй элементүүдэд задардаг.

Мөн нүүрстөрөгчийн усан уусмалыг үйлдвэрлэлд идэвхтэй ашигладаг. Цардуулаас H 2 O-тай тооцсон урвалын улмаас бараг бүх амттангийн нэг хэсэг болох глюкоз, молассыг гаргаж авдаг.

Өөр нэг полисахарид нь үйлдвэрлэлийн салбарт идэвхтэй ашиглагддаг шим тэжээлба бүтээгдэхүүн - энэ бол целлюлоз юм. Тэд үүнээс гаргаж авдаг техникийн глицерин, этилен гликол, сорбитол, этилийн спиртийг бүгд сайн мэддэг.
Удаан хугацаагаар өртөх үед целлюлозын гидролиз үүсдэг өндөр температурмөн ашигт малтмалын хүчлүүд байгаа эсэх. Энэ урвалын эцсийн бүтээгдэхүүн нь цардуулын нэгэн адил глюкоз юм. Целлюлозын гидролиз нь цардуулынхаас илүү хэцүү гэдгийг санах нь зүйтэй, учир нь энэхүү полисахарид нь эрдэс хүчлийн нөлөөнд илүү тэсвэртэй байдаг. Гэсэн хэдий ч целлюлоз нь бүх дээд ургамлын эсийн хананы гол бүрэлдэхүүн хэсэг учраас түүнийг агуулсан түүхий эд нь цардуулаас хямд байдаг. Үүний зэрэгцээ целлюлозын глюкозыг техникийн хэрэгцээнд илүү ашигладаг бол цардуулын гидролизийн бүтээгдэхүүн нь хоол тэжээлд илүү тохиромжтой гэж үздэг.
Уургийн гидролиз
Уургууд нь гол зүйл юм барилгын материалбүх амьд организмын эсийн хувьд. Эдгээр нь олон тооны амин хүчлүүдээс бүрддэг бөгөөд биеийн хэвийн үйл ажиллагаанд маш чухал байдаг. Гэсэн хэдий ч өндөр молекул жинтэй нэгдлүүд учраас шингээлт муутай байдаг. Хялбаршуулахын тулд энэ даалгавар, тэдгээрийн гидролиз үүсдэг.
Бусад органик бодисын нэгэн адил энэ урвал нь уурагуудыг бие махбодид амархан шингэдэг бага молекул жинтэй бүтээгдэхүүн болгон задалдаг.
Гидролиз нь давсыг устай солилцох урвал юм. давсны дериватив Энэ тохиолдолд анхны бодисыг усаар устгаж, шинэ бодисууд үүсдэг.
Гидролиз нь ионы солилцооны урвал учраас түүний хөдөлгөгч хүч нь сул электролит (хур тунадас ба / эсвэл хийн хувьсал) үүсэх явдал юм. Гидролизийн урвал нь урвуу урвал (ихэнх тохиолдолд) гэдгийг санах нь чухал боловч эргэлт буцалтгүй гидролиз бас байдаг (эцсээ хүртэл үргэлжилдэг, уусмалд ямар ч эхлэлийн бодис байхгүй болно). Гидролиз нь эндотермик процесс юм (температур нэмэгдэхийн хэрээр гидролизийн хурд болон гидролизийн бүтээгдэхүүний гарц хоёулаа нэмэгддэг).
Гидролиз нь солилцооны урвал гэсэн тодорхойлолтоос харахад метал нь OH - бүлэгт ордог (+ үндсэн давс үүссэн тохиолдолд хүчиллэг үлдэгдэл (хүчтэй давсны гидролизийн үед)) гэж үзэж болно. хүчил ба сул поли хүчлийн суурь)), хүчил үлдэгдэлд устөрөгчийн протон H + (+ байж болох металлын ион ба устөрөгчийн ион) байдаг бөгөөд хэрэв сул олон суурьт хүчлээр үүссэн давсыг гидролиз хийвэл хүчиллэг давс үүсдэг. )).
Гидролизийн 4 төрөл байдаг.
1. Хүчтэй суурь ба хүчтэй хүчлээс үүссэн давс. Дээр дурдсанчлан гидролиз нь ион солилцооны урвал бөгөөд энэ нь зөвхөн сул электролит үүсэх үед л тохиолддог. Дээр дурдсанчлан OH - бүлэг нь метал руу, устөрөгчийн протон H + хүчиллэг үлдэгдэл рүү ордог боловч хүчтэй суурь ба хүчтэй хүчил нь сул электролит биш тул энэ тохиолдолд гидролиз явагдахгүй.
NaCl + HOH ≠ NaOH + HCl
Орчны урвал нь саармагтай ойролцоо байна: рН≈7
2. Давс нь сул суурь ба хүчтэй хүчлээс үүсдэг. Дээр дурдсанчлан: OH - бүлэг нь метал руу, устөрөгчийн протон H + хүчиллэг үлдэгдэл рүү очдог. Жишээлбэл:
NH 4 Cl + HOH↔NH 4 OH + HCl
NH 4 + + Cl - + HOH↔NH 4 OH + H + + Cl -
NH 4 + + HOH↔NH 4 OH + H +
Жишээнээс харахад гидролиз нь катионоор явагддаг бөгөөд орчны урвал нь хүчиллэг рН юм < 7.При написании уравнений гидролиза для солей, образованных сильной кислотой и слабым многокислотным основанием, то в правой части следует писать основную соль, так как гидролиз идёт только по первой ступени:
FeCl 2 + HOH ↔ FeOHCl + HCl
Fe 2+ + 2Cl - + HOH↔FeO + + H + + 2Cl -
Fe 2+ + HOH ↔ FeOH + + H +
3. Давс нь сул хүчил ба хүчтэй суурийн нөлөөгөөр үүсдэг.Дээр дурдсанчлан: OH - бүлэг металл руу, устөрөгчийн протон H + хүчлийн үлдэгдэл рүү очно.Жишээ нь:
CH 3 COONa + HOH↔NaOH + CH 3 COOH
CH 3 COO - + Na + + HOH↔Na + + CH 3 COOH + OH -
CH 3 COO - + HOH↔ + CH 3 COOH + OH -
Гидролиз нь анионоор явагддаг, орчны урвал нь шүлтлэг, рН юм > 7. Сул олон суурьт хүчил ба хүчтэй суурийн нөлөөгөөр үүссэн давсны гидролизийн тэгшитгэлийг бичихдээ баруун талд нь хүчиллэг давс үүсэхийг бичих ба гидролиз 1 алхамаар явагдана. Жишээлбэл:
Na 2 CO 3 + HOH↔NaOH + NaHCO 3
2Na + + CO 3 2- + HOH↔HCO 3 - + 2Na + + OH -
CO 3 2- + HOH↔HCO 3 - + OH -
4. Давс нь сул суурь ба сул хүчлээс үүсдэг. Энэ нь зөвхөн гидролиз дуусах үед эргэлт буцалтгүй (анхны давс бүрэн дуусах хүртэл) тохиолддог. Жишээ нь:
CH 3 COONH 4 + HOH↔NH 4 OH + CH 3 COOH
Энэ нь гидролизийн төгсгөлд хүрэх цорын ганц тохиолдол юм. Гидролиз нь анион ба катионоор явагддаг; орчны урвалыг урьдчилан таамаглахад хэцүү боловч төвийг сахисантай ойролцоо байна: рН≈7.
Гидролизийн тогтмол хэмжигдэхүүн байдаг бөгөөд үүнийг ацетат ионы жишээн дээр авч үзье Ac - ... Дээрх жишээнүүдээс харахад цууны (этаны) хүчил нь сул хүчил тул түүний давс нь дараахь схемийн дагуу гидролиз болдог.
Ac - + HOH↔HAc + OH -
Энэ системийн тэнцвэрийн тогтмолыг олъё.
Мэдэх усны ионы бүтээгдэхүүн, бид түүгээр дамжуулан концентрацийг илэрхийлж болно [ OH] -,
![]()
Энэ илэрхийллийг гидролизийн тогтмолын тэгшитгэлд орлуулснаар бид дараахь зүйлийг авна.


Усны иончлолын тогтмолыг тэгшитгэлд орлуулснаар бид дараахь зүйлийг авна.

Гэхдээ тогтмол Хүчлийн диссоциаци (жишээлбэл, давсны хүчил) нь дараахтай тэнцүү байна.

Устөрөгчийн протон хаана байна: . Жишээлбэл, цууны хүчлийн хувьд ч мөн адил. Гидролизийн тогтмол тэгшитгэлд хүчлийн диссоциацийн тогтмолын утгыг орлуулснаар бид дараахь зүйлийг авна.
Жишээнээс харахад давс нь сул суурьтай үүссэн бол хуваагч нь хүчил диссоциацийн тогтмолтой ижил шалгуураар тооцоолсон суурь диссоциацийн тогтмол байх болно. Хэрэв давс нь сул суурь ба сул хүчлээс үүссэн бол хуваагч нь хүчил ба суурийн диссоциацийн тогтмолуудын үржвэр болно.
Гидролизийн зэрэг.
Гидролизийг тодорхойлдог өөр нэг утга байдаг - гидролизийн зэрэг -α нь тэнцүү байна гидролизд хийгдэж буй давсны хэмжээг (концентраци) ууссан давсны нийт хэмжээ (концентраци)-д харьцуулсан харьцааГидролизийн зэрэг нь давсны концентраци ба уусмалын температураас хамаарна. Энэ нь давсны уусмалыг шингэлж, уусмалын температур нэмэгдэх тусам нэмэгддэг. Уусмалыг шингэлэх тусам анхны давсны молийн концентраци бага байх болно гэдгийг санаарай; ба гидролиз нь дээр дурьдсанчлан эндотермик процесс тул гидролизийн зэрэг нь температур нэмэгдэх тусам нэмэгддэг.
Давсны гидролизийн зэрэг нь өндөр байх тусам түүнийг үүсгэдэг хүчил эсвэл суурь нь сул болно. Гидролизийн зэрэг ба гидролизийн төрлүүдийн тэгшитгэлээс дараахь байдлаар: эргэлт буцалтгүй гидролизтэй.α≈1.
Гидролизийн зэрэг ба гидролизийн тогтмол нь Оствальд тэгшитгэлээр харилцан хамааралтай.Вильгельм Фридрих ОствальдOstwald шингэлэх акт,-д харуулсан 1888жилШингэрэлтийн хууль нь электролитийн диссоциацийн зэрэг нь түүний концентраци болон диссоциацийн тогтмол байдлаас хамаардаг болохыг харуулж байна. Бодисын анхны концентрацийг дараах байдлаар авъяC 0, мөн бодисын салангид хэсэг - хувьдγ, бид уусмал дахь бодисыг задлах схемийг санаж байна.
AB↔A + + B -
Дараа нь Ostwald-ийн хуулийг дараах байдлаар илэрхийлж болно.
Тэгшитгэл нь тэнцвэрийн агшин дахь концентрацийг агуулдаг гэдгийг санаарай. Гэхдээ хэрэв бодис муу задарсан бол (1-γ) → 1 нь Оствальд тэгшитгэлийг дараах хэлбэртэй болгоно. K d = γ 2 C 0.
Гидролизийн зэрэг нь түүний тогтмол байдалтай ижил төстэй байдаг.
Ихэнх тохиолдолд энэ томъёог ашигладаг. Гэхдээ шаардлагатай бол гидролизийн түвшинг дараах томъёогоор илэрхийлж болно.

Гидролизийн онцгой тохиолдлууд:
1) Гидридийн гидролиз (устөрөгчийн элементүүдтэй нэгдлүүд (энд бид зөвхөн 1 ба 2-р бүлгийн металлууд ба метамыг авч үзэх болно), устөрөгч нь исэлдэлтийн түвшинг -1 харуулдаг):
NaH + HOH → NaOH + H 2
CaH 2 + 2HOH → Ca (OH) 2 + 2H 2
CH 4 + HOH → CO + 3H 2
Метантай хийсэн урвал нь устөрөгч үйлдвэрлэх үйлдвэрлэлийн аргуудын нэг юм.
2) Пероксидын гидролиз.Шүлт ба шүлтлэг шороон металлын хэт исэл нь усаар задардаг бөгөөд үүнд тохирох гидроксид ба устөрөгч (эсвэл хүчилтөрөгч) хэт исэл үүсдэг.
Na 2 O 2 +2 H 2 O → 2 NaOH + H 2 O 2
Na 2 O 2 + 2H 2 O → 2NaOH + O 2
3) Нитридын гидролиз.
Ca 3 N 2 + 6HOH → 3Ca (OH) 2 + 2NH 3
4) Фосфидын гидролиз.
K 3 P + 3HOH → 3KOH + PH 3
Боловсруулсан хий PH 3 - фосфин, маш хортой, хор хөнөөлтэй мэдрэлийн систем... Мөн хүчилтөрөгчтэй харьцахдаа аяндаа шатах чадвартай. Та шөнөдөө намаг дундуур алхаж эсвэл оршуулгын газрын хажуугаар явж байсан уу? Бид ховор гэрлийн тэсрэлтүүдийг харсан - фосфин шатаж байгаа тул "тэнүүчлэх гэрэл" гарч ирдэг.
5) Карбидын гидролиз. Энд бид хоёр хариу үйлдэл үзүүлэх болно практик хэрэглээ, учир нь тэдгээрийн тусламжтайгаар алкан (1-р урвал) ба алкинуудын (2-р урвал) гомологийн цувралын 1 гишүүнийг олж авдаг.
Al 4 C 3 +12 HOH → 4 Al (OH) 3 + 3CH 4 (урвал 1)
СаC 2 +2 HOH → Ca (OH) 2 + 2C 2 H 2 (урвал 2, бүтээгдэхүүн - ацитален, өөр UPA S etin)
6) Цахиурын гидролиз. Энэхүү урвалын үр дүнд силануудын гомологийн цувралын 1 төлөөлөгч (нийтдээ 8 байдаг) SiH 4 - мономер ковалент гидрид үүсдэг.
Mg 2 Si + 4HOH → 2Mg (OH) 2 + SiH 4
7) Фосфорын галидын гидролиз. Энд бид фосфорын хлорид 3 ба 5-ыг авч үзэх болно. фосфорын хүчилтус тус:
PCl 3 + 3H 2 O = H 3 PO 3 + 3HCl
PCl 5 + 4H 2 O = H 3 PO 4 + 5HCl
8) Органик бодисын гидролиз Өөх тос нь глицерин (C 3 H 5 (OH) 3) ба карбоксилын хүчил (ханасан карбоксилын хүчлийн жишээ) (C n H (2n + 1) COOH) үүсгэхийн тулд гидролиз болдог.
Эфир:
CH 3 COOCH 3 + H 2 O↔CH 3 COOH + CH 3 OH
Согтууруулах ундаа:
C 2 H 5 ONa + H 2 O↔C 2 H 5 OH + NaOH
Амьд организмууд урвалын явцад янз бүрийн органик бодисын гидролизийг гүйцэтгэдэгоролцоотойгоор катаболизм ферментүүд. Жишээлбэл, хоол боловсруулах ферментийн оролцоотой гидролизийн үедуураг нь амин хүчлүүд, өөх тос - глицерол ба тосны хүчил, полисахаридууд - моносахаридууд (жишээлбэл, глюкоз) болж задардаг.
Шүлтүүдийн дэргэд өөх тосны гидролиз үүсдэг саван; оршихуйд өөх тосны гидролизкатализаторууд авахад ашигладагглицин ба тосны хүчил.
Даалгаврууд
1) 18 ° C температурт 0.1 М уусмал дахь цууны хүчлийн диссоциацийн зэрэг нь 1.4 · 10-2-тэй тэнцүү байна. K d хүчлийн диссоциацийн тогтмолыг тооцоол.(Зөвлөгөө - Оствальд тэгшитгэлийг ашигла.)
2) Гарсан хийг 6.96 г төмрийн исэл болгон бууруулахын тулд ямар масстай кальцийн гидридийг усанд уусгах шаардлагатай вэ? II, III)?
3) Fe 2 (SO 4) 3 + Na 2 CO 3 + H 2 O урвалын тэгшитгэлийг бичнэ үү.
4) Зөвхөн гидролизийн 1-р үе шатыг харгалзан Cm = 0.03 М концентрацийн хувьд Na 2 SO 3 давсны гидролизийн тогтмол, градусыг тооцоол. (Хүхрийн хүчлийн диссоциацийн тогтмолыг 6.3 ∙ 10 -8-тай тэнцүү авна)
Шийдэл:
a) Эдгээр асуудлыг Оствальд шингэрүүлэлтийн хуульд орлуулна уу:
b) K d = · [C] = (1.4 · 10 –2) · 0.1 / (1 - 0.014) = 1.99 · 10 –5
Хариулт. K d = 1.99 · 10 –5.
в) Fe 3 O 4 + 4H 2 → 4H 2 O + 3Fe
CaH 2 + HOH → Ca (OH) 2 + 2H 2
Бид төмрийн ислийн моль (II, III)-ийн тоог олно, энэ нь тухайн бодисын массыг түүний молийн масстай харьцуулсан харьцаатай тэнцүү байна, бид 0.03 (моль) авна.UHR-ээр бид кальцийн гидридын моль олддог. нь 0.06 (моль).Тэгэхээр кальцийн гидридын масс 2.52 (грамм)-тай тэнцүү байна.
Хариулт: 2.52 (грамм).
d) Fe 2 (SO 4) 3 + 3Na 2 CO 3 + 3H 2 O → 3CO2 + 2Fe (OH) 3 ↓ + 3Na 2 SO 4
д) Натрийн сульфит нь анионы нөлөөгөөр гидролизд ордог, давсны уусмалын орчны урвал нь шүлтлэг (рН> 7):
SO 3 2- + H 2 O<-->OH - + HSO 3 -
Гидролизийн тогтмол (дээрх тэгшитгэлийг үзнэ үү) нь: 10 -14 / 6.3 * 10 -8 = 1.58 * 10 -7
Гидролизийн зэргийг α 2 / (1 - α) = K h / C 0 томъёогоор тооцоолно.
Тэгэхээр α = (K h / C 0) 1/2 = (1.58 * 10 -7 / 0.03) 1/2 = 2.3 * 10 -3
Хариулт: K h = 1.58 * 10 -7; α = 2.3 * 10 -3
Редактор: Харламова Галина Николаевна
Гидролизээргэж нэрлэдэг
урвалууд
солилцох
харилцан үйлчлэл
устай бодисууд, тэдгээрийн
задрал.
Онцлог шинж чанарууд
Органик бодисын гидролизбодисууд
Амьд организм гүйцэтгэдэг
янз бүрийн органик бодисын гидролиз
үед урвалын явцад бодис
ферментийн оролцоо.
Жишээлбэл, гидролизийн үед
хоол боловсруулах эрхтний оролцоо
ферментүүд УУРАГ нь задардаг
Амин хүчлийн хувьд,
Өөх тос - ГЛИЦЕРИН болон
ТОСНЫ ХҮЧИЛ,
ПОЛИСАХАРИД (жишээлбэл,
цардуул ба целлюлоз) - дээр
МОНОСАХАРИД (жишээлбэл, дээр
Глюкоз), цөмийн
ХҮЧИЛ - үнэ төлбөргүй
НУКЛЕОТИД.
Өөх тосны гидролиз үүсэх үед
шүлтүүд байгаа эсэх
саван авах; гидролиз
дэргэд нь өөх тос
ашигласан катализатор
глицерин болон
өөх тосны хүчил. Гидролизээр
мод этанол авах ба
хүлэрт гидролизийн бүтээгдэхүүн
програмыг олох
тэжээлийн үйлдвэрлэл
мөөгөнцөр, лав, бордоо болон
доктор.
Органик нэгдлүүдийн гидролиз
өөх тос нь гидролиз болж глицерин бакарбоксилын хүчил (NaOH - саванжуулах).
цардуул ба целлюлоз нь гидролиз болж хувирдаг
глюкоз:
Эргэдэг ба эргэлт буцалтгүй гидролиз
Бараг бүх гидролизийн урвалуудорганик бодис
буцаах боломжтой. Гэхдээ бас байдаг
эргэлт буцалтгүй гидролиз.
Эргэшгүй ерөнхий өмч
гидролиз - нэг (хоёуланг нь илүү сайн)
гидролизийн бүтээгдэхүүнээс
урвалын хүрээнээс зайлуулна
зэрэг:
- төсөл,
- ХИЙ.
CaC₂ + 2H₂O = Ca (OH) ₂ ↓ + C₂H₂
Давсны гидролизийн үед:
Al₄C₃ + 12 H₂O = 4 Al (OH) ₃ ↓ + 3CH₄
Al₂S₃ + 6 H₂O = 2 Al (OH) ₃ ↓ + 3 H₂S
CaH₂ + 2 H₂O = 2Ca (OH) ₂ ↓ + H₂
Г И Д Р О Л И З С О Л ЭЙ
Давсны гидролизДавсны гидролиз -
төрлийн урвалууд
улмаас гидролиз
урвалууд
уусмал дахь ионы солилцоо
(усан) уусдаг
электролитийн давс.
Хөдөлгөгч хүчүйл явц
харилцан үйлчлэл юм
устай ионууд хүргэж,
сул дорой хүмүүсийн боловсрол
ион дахь электролит буюу
молекул хэлбэр
("Ион холбох").
Буцах боломжтой ба хоёрыг ялгах
давсны эргэлт буцалтгүй гидролиз.
1. Сул давсны гидролиз
хүчил ба хүчтэй суурь
(анионик гидролиз).
2. Хүчтэй давсны гидролиз
хүчил ба сул суурь
(катионоор гидролиз).
3. Сул давсны гидролиз
хүчил ба сул суурь
(эргэлт буцалтгүй).
Хүчтэй хүчил давс ба
бат бөх суурь биш
гидролизд ордог.
Урвалын тэгшитгэл
Сул хүчил ба хүчтэй суурийн давсны гидролиз(анионы гидролиз):
(уусмал нь шүлтлэг орчинтой тул урвал явагдана
Хоёр дахь үе шатанд гидролиз урвуу байдлаар явагдана
ач холбогдолгүй).
Хүчтэй хүчил ба сул суурийн давсны гидролиз
(катионоор гидролиз):
(уусмал нь хүчиллэг орчинтой, урвал нь буцах боломжтой,
Хоёр дахь үе шатанд гидролиз бага зэрэг явагддаг
зэрэг).
10.
Сул хүчил ба сул суурийн давсны гидролиз:(тэнцвэр нь бүтээгдэхүүн рүү шилждэг, гидролиз
хоёр бүтээгдэхүүнээс хойш бараг бүрэн урсдаг
урвалууд нь урвалын бүсийг тунадас хэлбэрээр орхих буюу
хий).
Хүчтэй хүчил ба хүчтэй суурийн давс нь тийм биш юм
гидролизд ордог ба уусмал нь төвийг сахисан байдаг.
11. НАТРИЙН КАРБОНАТЫН ГИДРОЛИЗИЙН СҮХВ
Na₂CO₃NaOH
хүчтэй суурь
H₂CO₃
сул хүчил
ШҮЛТЛЭГ ДУНД
ХҮЧЛИЙН ДАВС, гидролиз
АНион
12. ЗЭС (II) ХЛОРИДЫН ГИДРОЛИЗИЙН СҮХБЭЭ
CuCl₂Cu (OH) ₂ ↓
сул суурь
HCl
хүчтэй хүчил
Хүчиллэг орчин
ҮНДСЭН ДАВС, гидролиз
CATION
13. ХӨНГӨНГӨН СҮЛФИДИЙН ГИДРОЛИЗИЙН СҮХБЭЭ
Al₂S₃Al (OH) ₃ ↓
сул суурь
H₂S
сул хүчил
саармаг урвал
ОРЧИН
эргэлт буцалтгүй гидролиз
14.
ГИДРОЛИЗИЙН БАЙГАЛЬД ГҮЙЦЭТГЭХ ГҮЙЦЭТГЭЛӨөрчлөлт царцдас
Далайн бага зэрэг шүлтлэг орчинг бүрдүүлэх
ус
ГИДРОЛИЗИЙН АМЬДРАЛД ГҮЙЦЭТГЭХ ГҮЙЦЭТГЭЛ
ХҮН
Угаах
Аяга таваг угаах
Савангаар угаах
Хоол боловсруулах үйл явц
1). Гидролиз нь эндотермик урвал тул температурын өсөлт нь гидролизийг нэмэгдүүлдэг.
2). Устөрөгчийн ионы концентраци нэмэгдэх нь катион гидролизийн тохиолдолд гидролизийг сулруулдаг. Үүний нэгэн адил гидроксидын ионы концентрацийг нэмэгдүүлэх нь анионы гидролизийн хувьд гидролизийг сулруулдаг.
3). Усаар шингэлэх үед тэнцвэр нь урвалын чиглэлд шилждэг, өөрөөр хэлбэл. баруун тийш, гидролизийн зэрэг нэмэгддэг.
4). Эдгээр бодисууд урвалд оролцогчдын аль нэгтэй урвалд ороход гадны бодис нэмэгдэх нь тэнцвэрт байдалд нөлөөлж болно. Тиймээс уусмалд зэсийн сульфат нэмэхэд
2CuSO4 + 2H2O<=>(CuOH) 2SO4 + H2SO4
натрийн гидроксидын уусмал, түүнд агуулагдах гидроксидын ионууд устөрөгчийн ионуудтай харилцан үйлчилнэ. Үүний үр дүнд тэдгээрийн концентраци буурч, Ле Шательегийн зарчмын дагуу систем дэх тэнцвэрт байдал баруун тийш шилжиж, гидролизийн зэрэг нэмэгдэнэ. Хэрэв ижил уусмалд натрийн сульфидын уусмал нэмбэл тэнцвэр нь таны таамаглаж байсанчлан баруун тийш шилжихгүй (гидролизийг харилцан сайжруулах), харин эсрэгээр зэсийг холбосноор зүүн тийш шилжих болно. ионуудаас бараг уусдаггүй зэсийн сульфид хүртэл .
5). Давсны концентраци. Энэ хүчин зүйлийг харгалзан үзэх нь парадоксик дүгнэлтэд хүргэдэг: систем дэх тэнцвэрт байдал нь Ле Шательегийн зарчмын дагуу баруун тийш шилждэг боловч гидролизийн зэрэг буурдаг.
Жишээ нь,
Аль (NO 3 ) 3
Давс нь катион гидролизд ордог. Энэ давсны гидролизийг дараах тохиолдолд сайжруулж болно.
- уусмалыг халаах буюу усаар шингэлэх;
- шүлтийн уусмал (NaOH) нэмнэ;
- Na 2 CO 3-ийн анионоор гидролиз болсон давсны уусмал нэмнэ;
- хүйтэнд хар тугалга уусгах;
- Аль (NO 3) 3-ийн хамгийн их төвлөрсөн уусмалыг аль болох бэлтгэх;
- уусмалд хүчил нэмнэ, жишээ нь HCl
Полихүчлийн суурийн болон олон суурьт хүчлүүдийн давсны гидролиз нь үе шаттайгаар явагддаг
Жишээлбэл, төмрийн (II) хлоридын гидролиз нь хоёр үе шатыг агуулдаг.
1-р шат
FeCl 2 + HOH<=>Fe (OH) Cl + HCl
Fe 2+ + 2Cl - + H + + OH -<=>Fe (OH) + + 2Cl - + H +
2-р шат
Fe (OH) Cl + HOH<=>Fe (OH) 2 + HCl
Fe (OH) + + Cl - + H + + OH -<=>Fe ( OH) 2 + H + + Cl -
Натрийн карбонатын гидролиз нь хоёр үе шатыг агуулдаг.
1-р шат
Na 2 CO 3 + HOH<=>NaNSO 3 + NaOH
CO 3 2- + 2Na + + H + + OH - => HCO 3 - + OH - + 2Na +
2-р шат
NaHCO 3 + H 2 O<=>NaOH + H 2 CO 3
HCO 3 - + Na + + H + + OH -<=>H 2 CO 3 + OH - + Na +
Гидролиз нь буцах боломжтой процесс юм. Устөрөгчийн ион ба гидроксидын ионуудын концентраци нэмэгдэх нь урвалыг эцэс хүртэл үргэлжлүүлэхэд саад болдог. Гидролизтэй зэрэгцэн үүссэн сул суурь (Fe (OH) 2) нь хүчтэй хүчилтэй, үүссэн сул хүчил (H 2 CO 3) шүлттэй харилцан үйлчлэх үед саармагжуулах урвал явагдана.
Хэрэв урвалын үр дүнд уусдаггүй суурь ба (эсвэл) дэгдэмхий хүчил үүссэн бол гидролиз нь эргэлт буцалтгүй болно.
Al 2 S 3 + 6H 2 O => 2Al (OH) 3 ↓ + 3H 2 S
Биологийн хувьд бүрэн задрах давс -Аль 2 S 3 Усан уусмал дахь солилцооны урвалаар олж авах боломжгүй, учир нь солилцооны оронд хамтарсан гидролизийн урвал явагдана.
2AlCl 3 + 3Na 2 S ≠ Al 2 S 3 + 6NaCl
2AlCl 3 + 3Na 2 S + 6H 2 O = 2Al (OH) 3 ↓ + 6NaCl + 3H 2 S(гидролизийг харилцан сайжруулах)
Тиймээс тэдгээрийг усгүй орчинд шингэлэх эсвэл бусад аргаар олж авдаг, жишээлбэл:
2Al + 3S = t ° C= Al 2 S 3
Гидролизийн урвалын жишээ
(NH 4) 2 CO 3 аммонийн карбонат - давс, сул хүчил, сул суурь. Уусдаг. Энэ нь катион ба анионоор нэгэн зэрэг гидролиз болдог. Алхамуудын тоо 2 байна.
1-р шат: (NH 4) 2 CO 3 + H 2 O ↔ NH 4 OH + NH 4 HCO 3
2-р шат: NH 4 HCO 3 + H 2 O ↔NH 4 OH + H 2 CO 3
Аммонийн гидроксид нь нүүрстөрөгчийн хүчлээс илүү хүчтэй электролит учраас уусмалын урвал бага зэрэг шүлтлэг, рН>7 байна. K d (NH 4 OH)> K d (H 2 CO 3)
CH 3 COONH 4 аммонийн ацетат - давс, сул хүчил, сул суурь. Уусдаг. Энэ нь катион ба анионоор нэгэн зэрэг гидролиз болдог. Алхамуудын тоо 1 байна.
CH 3 COONH 4 + H 2 O ↔NH 4 OH + CH 3 COOH
Уусмалын урвал нь төвийг сахисан рН = 7, учир нь K d (CH 3 COO H) = K d (NH 4 OH))
K 2 HPO 4- калийн устөрөгчийн фосфат- давс, сул хүчил, хүчтэй суурь. Уусдаг. Анион гидролиз болсон. Алхамуудын тоо 2 байна.
1-р шат: K 2 HPO 4 + H 2 O ↔KH 2 PO 4 + KOH
2-р шат: KH 2 PO 4 + H 2 O ↔H 3 PO 4 + KOH
Уусмалын урвал 1 алхам бага зэрэг шүлтлэгрН=8,9 , гидролизийн үр дүнд уусмалд OH - ионууд хуримтлагдаж, гидролизийн процесс нь HPO 4 2- ионуудын диссоциацаас давамгайлж, H + ионуудыг (HPO 4 2- ↔H + + PO 4 3-) өгдөг.
Уусмалын урвал 2 алхам бага зэрэг хүчиллэгрН=6,4 , учир нь дигидроортофосфатын ионуудын диссоциацийн процесс нь гидролизийн процессоос давамгайлж байхад устөрөгчийн ионууд нь зөвхөн гидроксидын ионыг саармагжуулаад зогсохгүй илүүдэл хэвээр үлддэг нь орчны сул хүчиллэг урвал үүсгэдэг.
Даалгавар: Натрийн бикарбонат ба натрийн устөрөгчийн сульфитын уусмалын орчинг тодорхойлно.
Шийдэл:
1) Натрийн бикарбонатын уусмал дахь үйл явцыг авч үзье. Энэ давсны задрал нь хоёр үе шаттайгаар явагддаг бөгөөд хоёр дахь шатанд устөрөгчийн катионууд үүсдэг.
NaHCO 3 = Na + + HCO 3 - (I)
HCO 3 - ↔ H + + CO 3 2- (II)
Хоёр дахь шатны диссоциацийн тогтмол нь нүүрстөрөгчийн хүчлийн K 2, 4.8 ∙ 10 -11-тэй тэнцүү.
Натрийн бикарбонатын гидролизийг дараахь томъёогоор тодорхойлно.
NaHCO 3 + H 2 O ↔ H 2 CO 3 + NaOH
HCO 3 - + H 2 O ↔H 2 CO 3 + OH -, тогтмол нь
K g = K w / K 1 (H 2 CO 3) = 1 ∙ 10 -14 / 4.5 ∙ 10 -7 = 2.2 ∙ 10 -8.
Гидролизийн тогтмол нь диссоциацийн тогтмолоос хамаагүй өндөр байдаг шийдэлNaHCO 3 шүлтлэг орчинтой.
2) Натрийн гидросульфитын уусмал дахь үйл явцыг авч үзье. Энэ давсны задрал нь хоёр үе шаттайгаар явагддаг бөгөөд хоёр дахь шатанд устөрөгчийн катионууд үүсдэг.
NaHSO 3 = Na + + HSO 3 - (I)
HSO 3 - ↔ H + + SO 3 2- (II)
Хоёр дахь шатны диссоциацийн тогтмол нь хүхрийн хүчлийн K 2, 6.2 ∙ 10 -8-тай тэнцүү.
Натрийн гидросульфитын гидролизийг дараахь томъёогоор тодорхойлно.
NaHSO 3 + H 2 O ↔H 2 SO 3 + NaOH
HSO 3 - + H 2 O ↔H 2 SO 3 + OH -, тогтмол нь
K g = K w / K 1 (H 2 SO 3) = 1 ∙ 10 -14 / 1.7 ∙ 10 -2 = 5.9 ∙ 10 -13.
Энэ тохиолдолд диссоциацийн тогтмол нь гидролизийн тогтмолоос их байна шийдэл
NaHSO 3 хүчиллэг орчинтой.
Даалгавар: Аммонийн цианидын давсны уусмалын орчныг тодорхойлно.
Шийдэл:
NH 4 CN ↔NH 4 + + CN -
NH 4 + + 2H 2 O ↔NH 3. H 2 O + H 3 O +
CN - + H 2 O ↔HCN + OH -
NH 4 CN + H 2 O↔ NH 4 OH + HCN
К д (HCN) = 7.2 ∙ 10 -10; K d (NH 4 OH) = 1.8 ∙ 10 -5
Хариулт: Катион ба анионы гидролиз, учир нь Ко> К k, бага зэрэг шүлтлэг орчин, рН>7
Бичлэг

1 ОРГАНИК БОЛОН ОРГАНИК БАЙДЛЫН ГИДРОЛИЗ.
2 Гидролиз (эртний Грекийн "ὕδωρ" ус ба "λύσις" задралаас) нэг төрлийн химийн урвал, энд бодисууд устай харилцан үйлчлэхэд анхны бодис нь шинэ нэгдлүүд үүсэх замаар задардаг. Төрөл бүрийн ангиллын нэгдлүүдийн гидролизийн механизм: - давс, нүүрс ус, өөх тос, эфир гэх мэт ихээхэн ялгаатай байдаг.
3 Органик бодисын гидролиз Амьд организм янз бүрийн органик бодисын гидролизийг ФЕРМЕНТИЙН оролцоотойгоор урвалын явцад гүйцэтгэдэг. Жишээлбэл, хоол боловсруулах ферментийн оролцоотой гидролизийн явцад уургууд нь АМИН хүчил, өөх тосыг глицерин ба өөхний хүчил, полисахаридууд (жишээлбэл, цардуул, целлюлоз) МОНОСАХАРИД (жишээлбэл, глюкоз), ANUACLETIC зэрэгт задардаг. NUCLEETES руу. Шүлт агуулсан өөх тосны гидролиз нь саван үүсгэдэг; катализаторын оролцоотойгоор өөх тосны гидролизийг глицерин ба тосны хүчлийг олж авахад ашигладаг. Этанолыг модны гидролизийн аргаар гаргаж авдаг бөгөөд хүлэрт гидролизийн бүтээгдэхүүнийг тэжээлийн мөөгөнцөр, лав, бордоо гэх мэт үйлдвэрлэлд ашигладаг.

4 1. Органик нэгдлүүдийн гидролиз нь өөх тос гидролиз болж глицерин ба карбоксилын хүчлүүд (NaOH-тай саванжих):
5 цардуул ба целлюлоз нь глюкоз болж гидролиз болдог.
7 ТУРШИЛТ 1. Өөх тосны гидролизийн үр дүнд 1) спирт, эрдэс хүчил 2) альдегид ба карбоксилын хүчил 3) нэг атомт спирт ба карбоксилын хүчил 4) глицерин ба карбоксилын хүчил ХАРИУЛТ: 4 2. Гидролизэд: 1) ацетилен 2) целлюлоз үүсдэг. 4) Метан ХАРИУЛТ: 2 3. Гидролиз нь: 1) Глюкоз 2) Глицерин 3) Өөх тос 4) Цууны хүчил ХАРИУЛТ: 3
8 4. Эфирийн гидролизийн үр дүнд: 1) Спирт ба альдегид 2) Карбоксилын хүчил ба глюкоз 3) Цардуул ба глюкоз 4) Спирт ба карбоксилын хүчил ХАРИУЛТ: 4 5. Цардуулын гидролизийн үр дүнд: 1) Сахароз 2) Fructose 2) үүсдэг. Мальтоз 4) Глюкоз ХАРИУЛТ: 4
9 2. Урвуу ба эргэлт буцалтгүй гидролиз Органик бодисын гидролизийн гэж үзэж буй бараг бүх урвалууд буцах боломжтой байдаг. Гэхдээ эргэлт буцалтгүй гидролиз бас байдаг. Эргэшгүй гидролизийн ерөнхий шинж чанар нь гидролизийн бүтээгдэхүүнүүдийн нэгийг (хоёуланг нь илүү сайн) урвалын бөмбөрцөгөөс: - ТУНАС, - ХИЙ хэлбэрээр зайлуулах ёстой. CaC₂ + 2H₂O = Ca (OH) ₂ + C₂H₂ Давсны гидролизд: Al₄C₃ + 12 H₂O = 4 Al (OH) ₃ + 3CH₄ Al₂S₃ + 6 H₂O CaH₃ + 6 H₂O CaH₂ + S₂ (H₂O 2 Al₂ + S₂) = 2Ca (OH ) ₂ + H₂
10 GIDROLIZSOL EY Давсны гидролиз нь (усан) уусдаг электролитийн давсны уусмалд ион солилцооны урвал явагдахаас үүсдэг гидролизийн урвалын нэг төрөл юм. Процессын хөдөлгөгч хүч нь ионуудын устай харилцан үйлчлэлцэх явдал бөгөөд ион эсвэл молекул хэлбэрээр сул электролит үүсэхэд хүргэдэг ("ионыг холбох"). Давсны эргэлт буцалтгүй гидролизийг ялгах. 1. Сул хүчил ба хүчтэй суурийн давсны гидролиз (анионик гидролиз). 2. Хүчтэй хүчил ба сул суурийн давсны гидролиз (катион гидролиз). 3. Сул хүчил ба сул суурийн давсны гидролиз (эргэлт буцалтгүй) Хүчтэй хүчил ба хүчтэй суурийн давс нь гидролизд ордоггүй.
12 1. Сул хүчил ба хүчтэй суурийн давсны гидролиз (анионы нөлөөгөөр гидролиз): (уусмал нь шүлтлэг орчинтой, урвал нь буцах, 2-р шатлалын гидролиз нь ач холбогдолгүй) 2. Нэг давсны гидролиз. Хүчтэй хүчил ба сул суурь (катионоор гидролиз): (уусмал нь хүчиллэг орчинтой, урвал нь буцах боломжтой, хоёр дахь шат дамжсан гидролиз нь үл тоомсорлодог)
13 3. Сул хүчил ба сул суурийн давсны гидролиз: (тэнцвэр нь бүтээгдэхүүн рүү шилждэг, гидролиз бараг бүрэн явагддаг, учир нь урвалын бүтээгдэхүүн хоёулаа урвалын бүсээс тунадас эсвэл хий хэлбэрээр гардаг). Хүчтэй хүчил ба хүчтэй суурийн давс нь гидролизд ордоггүй бөгөөд уусмал нь төвийг сахисан байдаг.
14 НАТРИЙН КАРБОНАТЫН гидролизийн схем NaOH хүчтэй суурь Na₂CO₃ H₂CO₃ сул хүчил> [H] + ШҮТЛЭГ ДУНД ХҮЧЛИЙН ДАВС, АНИОН гидролиз
15 Гидролизийн эхний үе шат Na₂CO₃ + H₂O NaOH + NaHCO₃ 2Na + + CO₃ ² + H₂O Na + + OH + Na + + HCO₃ CO₃ ² + H₂O OH + HCO₃ Гидролизийн 2-р шат Na₂CO₃ H₂O NaOH + HCO₃ NaHCO₃ + HO = HCO₃ + H₂O + OH + CO₂ + H₂O HCO₃ + H₂O = OH + CO₂ + H₂O
16 ЗЭС (II) хлоридын гидролизийн схем Cu (OH) ₂ сул суурь CuCl HCl хүчтэй хүчил< [ H ]+ КИСЛАЯ СРЕДА СОЛЬ ОСНОВНАЯ, гидролиз по КАТИОНУ
17 Гидролизийн эхний шат CuCl₂ + H₂O (CuOH) Cl + HCl Cu + ² + 2 Cl + H₂O (CuOH) + + Cl + H + + Cl Cu + ² + H₂O (CuOH) + + H + Гидролизийн хоёр дахь шат ( СuOH) Cl + H₂O Cu (OH) ₂ + HCl (Cu OH) + + Cl + H₂O Cu (OH) ₂ + H + + Cl (CuOH) + + H₂O Cu (OH) ₂ + H +
18 ХӨНГӨНГӨН ХӨНГӨНГӨН ХҮХЭРИЙН ГИДРОЛИЗИЙН БҮТЭЭГДЭХҮҮН Al₂S₃ Al (OH) ₃ H₂S сул суурь сул хүчил = [H] + НЕйтраль ДУНД РЕАКЦ эргэлт буцалтгүй гидролиз
19 Al₂S₃ + 6 H₂O = 2Al (OH) ₃ + 3H₂S НАТРИЙН ХЛОРИД ГИДРОЛИЗ NaCl NaOH HCl хүчтэй суурь хүчтэй хүчил = [H] + НЕйтр ДУНД УРАЛДАГ гидролизгүй NaCl + Na + H₂Ol = H₂Ol + NaCl + + OH + H + + Cl
20 Дэлхийн царцдасын өөрчлөлт Бага зэрэг шүлтлэг орчинг бүрдүүлэх далайн усХҮНИЙ АМЬДРАЛД ГИДРОЛИЗИЙН ГҮЙЦЭТГЭЛ Угаалга Аяга таваг угаах Савангаар угаах Хоол боловсруулах үйл явц
21 Гидролизийн тэгшитгэлийг бичнэ үү: A) K₂S B) FeCl₂ C) (NH₄) ₂S D) BaI₂ K₂S: KOH - хүчтэй суурь H₂S сул хүчил АНИОН ДАВСЫН ХҮЧЛИЙН ХҮЧЛИЙН ДУНД ХҮЧИЛ K₂ +OHS + H₂ +OHS + H₂ + SOH + SOH + H₂O + SOH + SOH + H₂O + SOH + SOH + H₂O + ШҮЛТИЙН ГИДРОЛИЗ K + HS + K + + OH S ² + H₂O HS + OH FeCl₂: Fe (OH) ₂ - сул суурь HCL - хүчтэй хүчил КАТОНИН ГИДРОЛИЗИЙН ДАВС ҮНДСЭН ДУНД ХҮЧИЛ FeCl₂ + H₂O (FeOH) Cl + HCl Fe + ² + H₂O ( FeOH) + + Cl + H + + Cl Fe + ² + H₂O (FeOH) + + H +
22 (NH₄) ₂S: NH₄OH - сул суурь; H₂S - сул хүчлийн ГИДРОЛИЗИЙН ЭРХИЙГ БИШГҮЙ (NH₄) ₂S + 2H₂O = H₂S + 2NH₄OH 2NH₃ 2H₂O BaI₂: Ba (OH) ₂ - хүчтэй суурь; HI - хүчтэй хүчил ГИДРОЛИЗИЙН №
23 Цаасан дээр бөглөнө үү. Дараагийн хичээл дээр ажлыг багшид хүлээлгэж өгнө.
25 7. Ямар давсны усан уусмал нь саармаг орчинтой вэ? a) Al (NO₃) ₃ b) ZnCl₂ c) BaCl₂ d) Fe (NO₃) ₂ 8. Ямар уусмалд лакмус өнгө цэнхэр өнгөтэй байх вэ? a) Fe₂ (SO₄) ₃ b) K₂S c) CuCl₂ d) (NH₄) ₂SO₄
26 9. Тэд гидролизд ордоггүй 1) калийн карбонат 2) этан 3) цайрын хлорид 4) өөх тос 10. Целлюлоз (цардуул) гидролиз үүсэхэд: 1) глюкоз 2) зөвхөн сахароз 3) зөвхөн фруктоз 4) нүүрстөрөгчийн давхар исэл ба ус. 11. Натрийн карбонатын гидролизийн үр дүнд үүссэн уусмал орчин 1) шүлтлэг 2) хүчтэй хүчиллэг 3) хүчиллэг 4) саармаг 12. Гидролизд ордог 1) CH 3 COOK 2) KCI 3) CaCO 3 4) Na 2 SO 4
27 13.Гидролизд орохгүй 1) төмрийн сульфат 2) спирт 3) аммонийн хлорид 4) эфир 14. Аммонийн хлоридын гидролизийн үр дүнд уусмалын орчин: 1) бага зэрэг шүлтлэг 2) хүчтэй шүлтлэг 3) хүчиллэг 4) саармаг
28 АСУУДАЛ Уусмал - FeCl₃, Na₂CO₃ - цутгахад тунадас, хий ялгардагийг тайлбарлана уу? 2FeCl₃ + 3Na₂CO₃ + 3H₂O = 2Fe (OH) ₃ + 6NaCl + 3CO₂
29 Fe + ³ + H₂O (FeOH) + ² + H + CO₃ ² + H₂O HCO₃ + OH CO₂ + H₂O Fe (OH) ₃
Гидролиз нь бодисын солилцооны задралын устай урвал юм. Органик бодисын гидролиз Органик бус бодис Давс Органик бодисын гидролиз Уураг Галоген алкан эфир (өөх тос) Нүүрс ус
ГИДРОЛИЗ Ерөнхий ойлголт Гидролиз гэдэг нь бодисуудын устай харилцан үйлчилж, задралд хүргэдэг бодисын солилцооны урвал юм. Төрөл бүрийн ангиллын органик бус болон органик бодисууд гидролиз болж болно.
11-р анги. Сэдэв 6. Хичээл 6. Давсны гидролиз. Хичээлийн зорилго: оюутнуудад давсны гидролизийн тухай ойлголтыг төлөвшүүлэх. Даалгавар: Боловсролын: оюутнуудад давсны уусмалын орчны шинж чанарыг найрлагаар нь тодорхойлох, гаргахыг заах.
MOU SOSH 1, Серухова, Москва муж Антошина Татьяна Александровна, химийн багш "11-р ангид гидролизийн судалгаа". Органик бус бодисын жишээн дээр сурагчид 9-р ангид анх удаа гидролизтэй танилцаж байна.
Давсны гидролиз Багшийн хийсэн ажил хамгийн дээд ангилалТимофеева В.Б. Гидролиз гэж юу вэ Гидролиз гэдэг нь нарийн төвөгтэй бодисуудын устай бодисын солилцооны харилцан үйлчлэлийн үйл явц юм Гидролиз Давсны устай харилцан үйлчлэх үйл явц
Боловсруулсан: Закаменскийн Агро аж үйлдвэрийн техникумын химийн багш Салисова Любовь Ивановна "Гидролиз" химийн сэдвээр арга зүйн гарын авлага. сургалтын гарын авлагадэлгэрэнгүй онолын мэдээллийг өгдөг
1 онол. Ион солилцооны урвалын ион-молекулын тэгшитгэл Ион солилцооны урвалыг электролитийн уусмал хоорондын урвал гэж нэрлэдэг бөгөөд үүний үр дүнд ионуудаа солилцдог. Ионы урвалууд
18. Уусмал дахь ионы урвал Электролитийн диссоциаци. Электролитийн диссоциаци нь эерэг ба сөрөг цэнэгтэй ионуудыг үүсгэх уусмал дахь молекулуудын задрал юм. Эвдрэлийн бүрэн байдал нь үүнээс хамаарна
КРАСНОДАР АЙМГИЙН БОЛОВСРОЛ, ШИНЖЛЭХ УХААНЫ ЯАМ улсын төсвийн мэргэжлийн боловсролын байгууллага Краснодар нутаг"Краснодар мэдээллийн технологийн коллеж" жагсаалт
12. Карбонилийн нэгдлүүд. Карбоксилын хүчил. Нүүрс ус. Карбонилийн нэгдлүүд Карбонилийн нэгдлүүдэд альдегид ба кетонууд ордог бөгөөд тэдгээрийн молекулууд нь карбонилийн бүлэг Альдегид агуулдаг.
Устөрөгчийн индекс ph Үзүүлэлтүүд Гидролизийн мөн чанар Давсны төрөл Давсны гидролизийн тэгшитгэл зохиох алгоритм Давсны гидролиз янз бүрийн төрөлГидролизийг дарах, сайжруулах арга Туршилтын уусмал В4 Устөрөгч
P \ n Сэдвийн хичээл I II III 9-р анги, 2014-2015 он хичээлийн жил, суурь түвшин, хими Хичээлийн сэдэв Цагийн тоо Ойролцоо нэр томъёо Мэдлэг, чадвар, ур чадвар. Электролитийн диссоциацийн онол (10 цаг) 1 Электролит
Давс тодорхойлох давс нарийн төвөгтэй бодисуудметаллын атом ба хүчиллэг үлдэгдэлээс үүссэн. Давсны ангилал 1. Металлын атом ба хүчиллэг үлдэгдэлээс тогтсон дунд зэргийн давс: NaCl натрийн хлорид. 2. Исгэлэн
Химийн хичээлийн А24 даалгавар 1. Зэс (ii) хлорид ба 1) кальцийн хлоридын уусмал 2) натрийн нитрат 3) хөнгөн цагаан сульфат 4) натрийн ацетат Зэс (ii) хлорид нь сул суурьтай давс юм.
Хотын төсвийн боловсролын байгууллага дунд иж бүрэн сургууль 4 Балтийск Ажлын программэрдмийн хичээл "Хими" 9-р анги, суурь түвшин Балтийск 2017 1. Тайлбар
9-р ангийн сурагчдын дунд шатны аттестатчилах даалгаврын банк A1. Атомын бүтэц. 1. Нүүрстөрөгчийн атомын цөмийн цэнэг 1) 3 2) 10 3) 12 4) 6 2. Натрийн атомын цөмийн цэнэг 1) 23 2) 11 3) 12 4) 4 3. Тоо цөм дэх протонуудын
3 Электролитийн уусмал Шингэн уусмалыг цахилгаан гүйдэл дамжуулах чадвартай электролитийн уусмал, цахилгаан дамжуулах чадваргүй электролитийн бус уусмал гэж хуваана. Электролит бус бодисуудад ууссан
Электролитийн диссоциацийн онолын үндсэн заалтууд Фарадей Майкл 22. IX.1791 25.VIII. 1867 Английн физикч, химич. 19-р зууны эхний хагаст. электролит ба электролит бус гэсэн ойлголтыг нэвтрүүлсэн. Бодис
Оюутны сургалтын түвшинд тавигдах шаардлага 9-р ангийн материалыг судалсны дараа оюутнууд дараахь зүйлийг хийх ёстой: Химийн элементүүдийг тэмдэгтээр, бодисыг томъёогоор, тэмдэг, химийн урвал явуулах нөхцөлөөр нэрлэх,
Хичээл 14 Давсны гидролиз Туршилт 1 1. Шүлтлэг орчинд уусмал байна l) Pb (NO 3) 2 2) Na 2 CO 3 3) NaCl 4) NaNO 3 2. В усан уусмалямар бодисын дунд төвийг сахисан байдаг вэ? l) NaNO 3 2) (NH 4) 2 SO 4 3) FeSO
ХӨТӨЛБӨРИЙН АГУУЛГА Бүлэг 1. Химийн элемент Сэдэв 1. Атомын бүтэц. Химийн элементүүдийн үечилсэн хууль ба үечилсэн систем D.I. Менделеев. Атомын бүтцийн талаархи орчин үеийн санаанууд.
Давсны химийн шинж чанар (дунд) АСУУЛТ 12 Давс нь металлын атом ба хүчлийн үлдэгдэлээс тогтсон нийлмэл бодис юм. Жишээ нь: Na 2 CO 3 натрийн карбонат; FeCl 3 төмрийн (III) хлорид; Al 2 (SO 4) 3
1. Дараах мэдэгдлүүдийн аль нь ханасан уусмалын хувьд үнэн бэ? 1) ханасан уусмалыг баяжуулж болно, 2) ханасан уусмалыг шингэлж болно, 3) ханасан уусмалыг чадахгүй.
Хотын төсвийн боловсролын байгууллага Павловская тосгоны 1-р дунд сургууль хотын захиргааКраснодар хязгаарын Павловский дүүргийн оюутны сургалтын систем
КРАСНОДАР АЙМГИЙН БОЛОВСРОЛ, ШИНЖЛЭХ УХААНЫ ЯАМ "НОВОРОССИЙСК РАДИО ЭЛЕКТРОН ТӨХӨӨРӨМЖИЙН КОЛЛЕЖ" ДУНД МЭРГЭЖЛИЙН БОЛОВСРОЛЫН УЛСЫН ТӨСӨВТТЭЙ БОЛОВСРОЛЫН БАЙГУУЛЛАГА
I. Оюутны сургалтын түвшинд тавигдах шаардлага Оюутнууд тухайн хэсгийг эзэмшсэний үр дүнд дараахь зүйлийг мэдэж байх / ойлгох ёстой: химийн тэмдэг: химийн элементийн тэмдэг, химийн томъёо, химийн тэгшитгэл.
Химийн 10-11-р ангийн дунд шатны гэрчилгээ А1 дээж Гадны энергийн түвшний ижил төстэй тохиргоонд нүүрстөрөгчийн атомууд ба 1) азот 2) хүчилтөрөгч 3) цахиур 4) фосфор А2 байна. Элементүүдийн дунд хөнгөн цагаан байдаг
А9 ба А10-ийн давталт (оксид ба гидроксидын шинж чанар); А11 Давсны химийн шинж чанар: дунд, хүчиллэг, суурь; цогцолбор (жишээ нь, хөнгөн цагаан, цайрын нэгдлүүд) А12 Органик бусын хамаарал
ТАЙЛБАР: Ажлын хөтөлбөрийг үндсэн чиглэлийн Загвар хөтөлбөрийн үндсэн дээр эмхэтгэсэн болно Ерөнхий боловсролхимийн чиглэлээр, түүнчлэн ерөнхий боловсролын сургуулийн 8-9-р ангийн сурагчдад зориулсан химийн хичээлийн хөтөлбөрүүд
Химийн 11-р ангийн тест (үндсэн түвшин) Тест "Химийн урвалын төрлүүд (химийн 11-р анги, үндсэн түвшин) Сонголт 1 1. Урвалын тэгшитгэлийг гүйцээж, тэдгээрийн төрлийг заана уу: a) Al 2 O 3 + HCl, b) Na 2 O + H 2 O,
Даалгавар 1. Эдгээр хольцын аль нь давсыг ус болон шүүх төхөөрөмж ашиглан бие биенээсээ салгах боломжтой вэ? a) BaSO 4 ба CaCO 3 b) BaSO 4 ба CaCl 2 c) BaCl 2 ба Na 2 SO 4 d) BaCl 2 ба Na 2 CO 3 Даалгавар
Электролитийн уусмал ХУВИЛБАР 1 1. Иодын хүчил, зэс (I) гидроксид, ортоарсений хүчил, зэс (II) гидроксидын электролитийн диссоциацийн процессын тэгшитгэлийг бич. Илэрхийлэл бичих
Химийн хичээл. (9-р анги) Сэдэв: Ион солилцооны урвал. Зорилго: Ионы солилцооны урвал, тэдгээрийн үүсэх нөхцөл, бүрэн ба товчилсон ион-молекул тэгшитгэлийн тухай ойлголтыг бий болгох, алгоритмтай танилцах.
ДАВСЫН ГИДРОЛИЗ Т.А.Колевич, Вадим Е.Матулис, Виталий Е.Матулис 1. Ус сул электролит болох Уусмалын устөрөгчийн илтгэгч (рН) Усны молекулын бүтцийг эргэн санацгаая. Хүчилтөрөгчийн атом нь устөрөгчийн атомуудтай холбогддог
Сэдэв ЭЛЕКТРОЛИТИЙН ДИССОЦИАЛЬ. ИОН СОЛИЛЦОХ РЕАКС Шалгасан агуулгын зүйл Даалгаврын маягт Макс. цэг 1. Электролит ба электролит бус VO 1 2. Электролитийн диссоциаци VO 1 3. Эргэшгүй нөхцөл
18 1-р хувилбарын түлхүүр Дараах химийн хувиргалтуудын дарааллаар харгалзах урвалын тэгшитгэлийг бичнэ үү: 1. Si SiH 4 SiO 2 H 2 SiO 3; 2. Cu. Cu (OH) 2 Cu (NO 3) 2 Cu 2 (OH) 2 CO 3; 3. Метан
Усть-Донецк муж x. Крымын хотын төсвийн боловсролын байгууллага Крымын дунд сургууль БАТЛАВ 2016 оны тушаал Сургуулийн захирал И.Н. Калитвенцева Ажлын хөтөлбөр
Ганцаарчилсан бие даалт 5. ОРЧНЫ УС ТӨРӨГЧИЙН ҮЗҮҮЛЭЛТ. ДАВСНЫ ГИДРОЛИЗИЙН ОНОЛЫН ХЭСЭГ Электролит нь цахилгаан гүйдэл дамжуулдаг бодис юм. Уусгагчийн үйлчлэлээр бодисыг ион болгон задлах үйл явц
1. Үндсэн шинж чанаруудыг элементийн гаднах исэл харуулж байна: 1) хүхэр 2) азот 3) бари 4) нүүрстөрөгч 2. Томъёоуудын аль нь электролитийн диссоциацийн түвшний илэрхийлэлтэй тохирч байна: 1) α = n. \ n 2) V m = V \ n 3) n =
Химийн хичээлийн А23 даалгавар 1. Ионы товчилсон тэгшитгэл нь харилцан үйлчлэлд тохирно.
1 Гидролиз Даалгаврын хариултууд нь үг, хэллэг, тоо эсвэл үгийн дараалал, тоо юм. Хариултаа хоосон зай, таслал болон бусад нэмэлт тэмдэгтгүйгээр бичнэ үү. хоорондын захидал харилцааг бий болгох
Даалгаврын банк 11-р анги хими 1. Цахим тохиргоо нь ионтой тохирч байна: 2. Бөөмүүд ба ба ба ба ижил тохиргоотой 3. Магнийн атом ба
Хуралдаанаар САМАРА ДҮҮРГИЙН "72-Р СУРГУУЛЬ" ХОТЫН ТӨСВИЙН БОЛОВСРОЛЫН БАЙГУУЛЛАГЫГ ХЭЛЭЛЦЭВ. арга зүйн нэгдэлбагш нар (МО-ын дарга: гарын үсэг, овог нэр) 20 минут