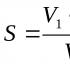Genetische Reihe, wie man sie löst. Genetische Verbindung von Metallen, Nichtmetallen und ihren Verbindungen
Genetische Reihe von Metallen und ihren Verbindungen
Jede dieser Reihen besteht aus einem Metall, seinem basischen Oxid, einer Base und einem beliebigen Salz desselben Metalls:
Um in all diesen Serien von Metallen zu basischen Oxiden zu gelangen, werden Kombinationsreaktionen mit Sauerstoff verwendet, zum Beispiel:
2Ca + O 2 \u003d 2CaO; 2Mg + O 2 \u003d 2MgO;
Der Übergang von basischen Oxiden zu Basen in den ersten beiden Reihen erfolgt durch die Ihnen bekannte Hydratationsreaktion, zum Beispiel:
CaO + H 2 O \u003d Ca (OH) 2.
In den letzten beiden Reihen reagieren die darin enthaltenen MgO- und FeO-Oxide nicht mit Wasser. In solchen Fällen werden zur Gewinnung von Basen diese Oxide zunächst in Salze und anschließend in Basen umgewandelt. Um beispielsweise den Übergang von MgO-Oxid zu Mg(OH)2-Hydroxid durchzuführen, werden daher aufeinanderfolgende Reaktionen verwendet:
MgO + H 2 SO 4 \u003d MgSO 4 + H 2 O; MgSO 4 + 2NaOH \u003d Mg (OH) 2 ↓ + Na 2 SO 4.
Die Übergänge von Basen zu Salzen erfolgen durch Ihnen bereits bekannte Reaktionen. So werden lösliche Basen (Laugen), die in den ersten beiden Reihen stehen, unter Einwirkung von Säuren, Säureoxiden oder Salzen in Salze umgewandelt. Unlösliche Basen aus den letzten beiden Reihen bilden unter Einwirkung von Säuren Salze.
Genetische Reihe von Nichtmetallen und ihren Verbindungen.
Jede dieser Reihen besteht aus einem Nichtmetall, einem Säureoxid, der entsprechenden Säure und einem Salz, das die Anionen dieser Säure enthält:
Um von Nichtmetallen zu sauren Oxiden zu gelangen, werden in all diesen Serien Reaktionen der Kombination mit Sauerstoff verwendet, zum Beispiel:
4P + 5O 2 \u003d 2 P 2 O 5; Si + O 2 \u003d SiO 2;
Der Übergang von sauren Oxiden zu Säuren in die ersten drei Reihen erfolgt durch die Ihnen bekannte Hydratationsreaktion, zum Beispiel:
P 2 O 5 + 3H 2 O \u003d 2 H 3 PO 4.
Sie wissen jedoch, dass das in der letzten Reihe enthaltene SiO 2 -Oxid nicht mit Wasser reagiert. Dabei wird es zunächst in das entsprechende Salz umgewandelt, aus dem dann die gewünschte Säure gewonnen wird:
SiO 2 + 2KOH = K 2 SiO 3 + H 2 O; K 2 SiO 3 + 2HСl \u003d 2KCl + H 2 SiO 3 ↓.
Die Übergänge von Säuren zu Salzen können durch Ihnen bekannte Reaktionen mit basischen Oxiden, Basen oder mit Salzen erfolgen.
Es sollte beachtet werden:
Substanzen derselben genetischen Serie reagieren nicht miteinander.
Substanzen genetischer Serien verschiedene Typen miteinander reagieren. Die Produkte solcher Reaktionen sind immer Salze (Abb. 5):
Reis. 5. Schema der Verwandtschaft von Stoffen verschiedener genetischer Serien.
Dieses Diagramm zeigt die Beziehung zwischen verschiedenen Klassen nicht organische Verbindungen und erklärt die Vielfalt chemische Reaktionen zwischen ihnen.
Themenaufgabe:
Schreiben Sie die Reaktionsgleichungen auf, mit denen Sie die folgenden Transformationen durchführen können:
1. Na → Na 2 O → NaOH → Na 2 CO 3 → Na 2 SO 4 → NaOH;
2. P → P 2 O 5 → H 3 PO 4 → K 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4;
3. Ca → CaO → Ca(OH) 2 → CaCl 2 → CaCO 3 → CaO;
4. S → SO 2 → H 2 SO 3 → K 2 SO 3 → H 2 SO 3 → BaSO 3;
5. Zn → ZnO → ZnCl 2 → Zn(OH) 2 → ZnSO 4 → Zn(OH) 2;
6. C → CO 2 → H 2 CO 3 → K 2 CO 3 → H 2 CO 3 → CaCO 3;
7. Al → Al 2 (SO 4) 3 → Al(OH) 3 → Al 2 O 3 → AlCl 3;
8. Fe → FeCl 2 → FeSO 4 → Fe(OH) 2 → FeO → Fe 3 (PO 4) 2;
9. Si → SiO 2 → H 2 SiO 3 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2;
10. Mg → MgCl 2 → Mg(OH) 2 → MgSO 4 → MgCO 3 → MgO;
11. K → KOH → K 2 CO 3 → KCl → K 2 SO 4 → KOH;
12. S → SO 2 → CaSO 3 → H 2 SO 3 → SO 2 → Na 2 SO 3;
13. S → H 2 S → Na 2 S → H 2 S → SO 2 → K 2 SO 3;
14. Cl 2 → HCl → AlCl 3 → KCl → HCl → H 2 CO 3 → CaCO 3;
15. FeO → Fe(OH) 2 → FeSO 4 → FeCl 2 → Fe(OH) 2 → FeO;
16. CO 2 → K 2 CO 3 → CaCO 3 → CO 2 → BaCO 3 → H 2 CO 3;
17. K 2 O → K 2 SO 4 → KOH → KCl → K 2 SO 4 → KNO 3;
18. P 2 O 5 → H 3 PO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → H 3 PO 4 → H 2 SO 3;
19. Al 2 O 3 → AlCl 3 → Al(OH) 3 → Al(NO 3) 3 → Al 2 (SO 4) 3 → AlCl 3;
20. SO 3 → H 2 SO 4 → FeSO 4 → Na 2 SO 4 → NaCl → HCl;
21. KOH → KCl → K 2 SO 4 → KOH → Zn(OH) 2 → ZnO;
22. Fe(OH) 2 → FeCl 2 → Fe(OH) 2 → FeSO 4 → Fe(NO 3) 2 → Fe;
23. Mg(OH) 2 → MgO → Mg(NO 3) 2 → MgSO 4 → Mg(OH) 2 → MgCl 2;
24. Al(OH) 3 → Al 2 O 3 → Al(NO 3) 3 → Al 2 (SO 4) 3 → AlCl 3 → Al(OH) 3;
25. H 2 SO 4 → MgSO 4 → Na 2 SO 4 → NaOH → NaNO 3 → HNO 3;
26. HNO 3 → Ca(NO 3) 2 → CaCO 3 → CaCl 2 → HCl → AlCl 3;
27. CuСO 3 → Cu(NO 3) 2 → Cu(OH) 2 → CuO → CuSO 4 → Cu;
28. MgSO 4 → MgCl 2 → Mg(OH) 2 → MgO → Mg(NO 3) 2 → MgCO 3;
29. K 2 S → H 2 S → Na 2 S → H 2 S → SO 2 → K 2 SO 3;
30. ZnSO 4 → Zn(OH) 2 → ZnCl 2 → HCl → AlCl 3 → Al(OH) 3;
31. Na 2 CO 3 → Na 2 SO 4 → NaOH → Cu(OH) 2 → H 2 O → HNO 3;
genetische Verbindung ist eine Beziehung zwischen Stoffen, die verschiedenen Klassen angehören.
Die Hauptmerkmale der genetischen Serie:
1. Alle Stoffe derselben Reihe müssen aus einem chemischen Element bestehen.
2. Stoffe, die aus demselben Element bestehen, müssen zu unterschiedlichen Klassen chemischer Stoffe gehören.
3. Stoffe, die die genetische Reihe eines Elements bilden, müssen durch gegenseitige Transformationen miteinander verbunden sein.
Auf diese Weise, genetisch eine Reihe von Stoffen benennen, die verschiedene Klassen anorganischer Verbindungen darstellen, Verbindungen desselben chemischen Elements sind, durch gegenseitige Umwandlungen verbunden sind und den gemeinsamen Ursprung dieser Stoffe widerspiegeln.
Bei Metallen werden drei Reihen genetisch verwandter Stoffe unterschieden, bei Nichtmetallen eine Reihe.
1. Genetische Reihe von Metallen, deren Hydroxide Basen (Alkalien) sind:
Metall→basisches Oxid→Base (Alkali)→Salz.
Zum Beispiel die genetische Reihe von Kalzium:
Ca → CaO → Ca(OH) 2 → CaCl 2
2. Genetische Reihe von Metallen, die amphotere Hydroxide bilden:
Salz
Metall→amphoteres Oxid→(Salz)→amphoteres Hydroxid
Zum Beispiel: ZnCl 2
Zn → ZnO → ZnSO 4 → Zn(OH) 2
(H 2 ZnO 2) ↓
Na 2 ZnO 2
Zinkoxid interagiert nicht mit Wasser, daher wird daraus zunächst ein Salz und dann Zinkhydroxid gewonnen. Das Gleiche gilt, wenn das Metall einer unlöslichen Base entspricht.
3. Genetische Reihe von Nichtmetallen (Nichtmetalle bilden nur saure Oxide):
Nichtmetall→Säureoxid→Säure→Salz
Zum Beispiel die genetische Reihe von Phosphor:
P → P 2 O 5 → H 3 PO 4 → K 3 PO 4
Der Übergang von einem Stoff zum anderen erfolgt mit Hilfe chemischer Reaktionen.
Anleitung für Studierende im Fernstudium „Allgemeine Chemie für die 12. Klasse“ 1. Studierendenkategorie: Die Materialien dieser Präsentation werden dem Studierenden zur Verfügung gestellt Selbststudium das Thema „Stoffe und ihre Eigenschaften“, aus dem Studiengang Allgemeine Chemie, Klasse 12. 2. Kursinhalt: beinhaltet 5 Themenvorträge. Jedes Lernthema enthält eine klare Struktur Unterrichtsmaterial zu einem bestimmten Thema ist die letzte Folie ein Kontrolltest – Aufgaben zur Selbstkontrolle. 3. Studiendauer für diesen Studiengang: von einer Woche bis zu zwei Monaten (individuell festgelegt). 4. Wissenskontrolle: Der Student erstellt einen Bericht über die Erledigung der Prüfungsaufgaben – ein Blatt mit Optionen für Aufgaben unter Angabe des Themas. 5. Bewertung des Ergebnisses: „3“ – 50 % der Aufgaben erledigt, „4“ – 75 %, „5“ % der Aufgaben. 6. Lernergebnis: Bestehen (nicht bestanden) des untersuchten Themas.


Reaktionsgleichungen: 1. 2Cu + o 2 2CuO Kupfer(II)-oxid 2. CuO + 2 HCl CuCl 2 + H 2 O Kupfer(II)-chlorid 3. CuCl NaOH Cu(OH) Na Cl Kupfer(II)-hydroxid 4. Cu (OH) 2 + H 2 SO 4 CuSO 4 + 2H 2 O Kupfer(II)sulfat



Genetische Reihe organischer Verbindungen. Wenn die Grundlage der genetischen Reihe der anorganischen Chemie Stoffe sind, die von einem chemischen Element gebildet werden, dann sind die Grundlage der genetischen Reihe in der organischen Chemie Stoffe mit die gleiche Nummer Kohlenstoffatome in einem Molekül.

Reaktionsschema: Jede Zahl über dem Pfeil entspricht einer bestimmten Reaktionsgleichung: Ethanal Ethanol Ethen Ethan Chlorethan Ethin Essigsäure (Ethansäure).

Reaktionsgleichungen: 1. C 2 H 5 Cl + H 2 O C 2 H 5 OH + HCl 2. C 2 H 5 OH + O CH 3 CHO + H 2 O 3. CH 3 CHO + H 2 C 2 H 5 OH 4. C 2 H 5 OH + HCl C 2 H 5 Cl + H 2 O 5. C 2 H 5 Cl C 2 H 4 + HCl 6. C 2 H 4 C 2 H 2 + H 2 7. C 2 H 2 + H 2 O CH 3 CHO 8. CH 3 CHO + Ag 2 O CH 3 COOH + Ag

Wiederholung. Genetische Verwandtschaft von Klassen anorganischer Verbindungen
Einführung
Das Thema dieser Lektion ist „Wiederholung. Genetische Verbindung von Klassen anorganischer Verbindungen“. Sie werden wiederholen, wie alle anorganischen Stoffe unterteilt werden, und daraus schließen, wie aus einer Klasse eine andere Klasse anorganischer Verbindungen gewonnen werden kann. Anhand der erhaltenen Informationen erfahren Sie, was die genetische Verbindung solcher Klassen ist und welche zwei Hauptwege solche Verbindungen haben.
Betreff: Einführung
Lektion: Wiederholung. Genetische Verwandtschaft von Klassen anorganischer Verbindungen
Chemie ist die Wissenschaft von Stoffen, ihren Eigenschaften und Umwandlungen ineinander.
Reis. 1. Genetische Verbindung von Klassen anorganischer Verbindungen
Alle anorganischen Stoffe können unterteilt werden in:
Einfache Substanzen
Komplexe Substanzen.
Einfache Stoffe werden unterteilt in:
Metalle
Nichtmetalle
Verbindungen können unterteilt werden in:
Stiftungen
Säuren
Salz. Siehe Abb.1.
Dabei handelt es sich um binäre Verbindungen, die aus zwei Elementen bestehen, von denen eines Sauerstoff in der Oxidationsstufe -2 ist. Abb.2.
Zum Beispiel Calciumoxid: Ca +2 O -2, Phosphoroxid (V) P 2 O 5., Stickoxid (IV) -« Fuchsschwanz“

Reis. 2. Oxide
Sind geteilt in:
Hauptsächlich
Sauer
Basische Oxide entsprechen Gründe.
Säureoxide entsprechen Säuren.
Salz besteht aus Metallkationen Und Säurerest-Anionen.

Reis. 3. Wege genetischer Beziehungen zwischen Substanzen
Somit: Aus einer Klasse anorganischer Verbindungen kann eine andere Klasse gewonnen werden.
Daher alle Klassen anorganischer Stoffe sind miteinander verbunden.
Klassenverbindung Anorganische Verbindungen werden oft genannt genetisch. Abb. 3.
Genesis bedeutet auf Griechisch „Ursprung“. Diese. Die genetische Verbindung zeigt den Zusammenhang zwischen der Umwandlung von Stoffen und ihrer Entstehung aus einem einzigen Stoff.
Es gibt zwei Hauptarten genetischer Beziehungen zwischen Substanzen. Einer von ihnen beginnt mit einem Metall, der andere mit einem Nichtmetall.
Metallgenetische Serie zeigt an:
Metall → Basisches Oxid → Salz → Base → Neues Salz.
Genetische Reihe eines Nichtmetalls spiegelt die folgenden Transformationen wider:
Nichtmetall → Säureoxid → Säure → Salz.
Für jede genetische Reihe kann man Reaktionsgleichungen schreiben, die dies zeigen die Umwandlung einer Substanz in eine andere.
Zunächst muss festgestellt werden, zu welcher Klasse anorganischer Verbindungen jeder Stoff der genetischen Reihe gehört.
denken wie man die Substanz, die hinter ihm steht, von der Substanz, die vor dem Pfeil steht, erhält.
Beispiel 1. Genetische Serie von Metall.

Die Serie beginnt mit einem einfachen Stoff, dem Metall Kupfer. Um den ersten Übergang durchzuführen, müssen Sie Kupfer in einer Sauerstoffatmosphäre verbrennen.
2Cu +O 2 →2CuO
Der zweite Übergang: Sie müssen das Salz CuCl 2 erhalten. Es wird durch Salzsäure HCl gebildet, da die Salze der Salzsäure Chloride genannt werden.
CuO +2 HCl → CuCl 2 + H 2 O
Der dritte Schritt: Um eine unlösliche Base zu erhalten, müssen Sie einem löslichen Salz Alkali hinzufügen.
CuCl 2 + 2NaOH → Cu(OH) 2 ↓ + 2NaCl
Um Kupfer(II)-hydroxid in Kupfer(II)-sulfat umzuwandeln, fügen Sie es hinzu Schwefelsäure H2SO4.
Cu(OH) 2 ↓ + H 2 SO 4 → CuSO 4 + 2H 2 O
Beispiel #2. Die genetische Reihe eines Nichtmetalls.

Die Serie beginnt mit einer einfachen Substanz, dem nichtmetallischen Kohlenstoff. Um den ersten Übergang zu vollziehen, müssen Sie Kohlenstoff in einer Sauerstoffatmosphäre verbrennen.
C + O 2 → CO 2
Wenn einem sauren Oxid Wasser zugesetzt wird, entsteht eine Säure, die Kohlensäure genannt wird.
CO 2 + H 2 O → H 2 CO 3
Um ein Salz der Kohlensäure – Calciumcarbonat – zu erhalten, müssen Sie der Säure eine Calciumverbindung hinzufügen, beispielsweise Calciumhydroxid Ca (OH) 2.
H 2 CO 3 + Ca (OH) 2 → CaCO 3 + 2H 2 O
Die Zusammensetzung jeder genetischen Reihe umfasst Substanzen verschiedener Klassen anorganischer Verbindungen.
Aber diese Stoffe enthalten notwendigerweise das gleiche Element. Wenn man die chemischen Eigenschaften von Verbindungsklassen kennt, ist es möglich, Reaktionsgleichungen auszuwählen, mit denen diese Transformationen durchgeführt werden können. Diese Umwandlungen werden auch in der Produktion genutzt, um die rationellsten Methoden zur Gewinnung bestimmter Stoffe auszuwählen.
Sie haben wiederholt, wie alle anorganischen Substanzen unterteilt werden, und kamen zu dem Schluss, wie aus einer Klasse eine andere Klasse anorganischer Verbindungen gewonnen werden kann. Basierend auf den erhaltenen Informationen haben wir herausgefunden, was die genetische Verwandtschaft dieser Klassen ist und welche zwei Hauptarten solche Beziehungen haben .
1. Rudzitis G.E. Anorganische und organische Chemie. Klasse 8: Lehrbuch für Bildungseinrichtungen: ein Grundniveau von/ G. E. Rudzitis, F.G. Feldman.M.: Aufklärung. 2011 176 S.: Abb.
2. Popel P.P. Chemie: 8. Klasse: ein Lehrbuch für allgemeinbildende Einrichtungen / P.P. Popel, L. S. Krivlya. -K.: IC „Academy“, 2008.-240 S.: Abb.
3. Gabrielyan O.S. Chemie. Klasse 9 Lehrbuch. Herausgeber: Drofa.: 2001. 224s.
1. Nr. 10-a, 10z (S. 112) Rudzitis G.E. Anorganische und organische Chemie. Klasse 8: Lehrbuch für Bildungseinrichtungen: Grundstufe / G. E. Rudzitis, F.G. Feldman.M.: Aufklärung. 2011 176s.: Abb.
2. Wie kann man auf zwei Arten Calciumsulfat aus Calciumoxid gewinnen?
3. Erstellen Sie eine genetische Serie zur Gewinnung von Bariumsulfat aus Schwefel. Schreiben Sie Reaktionsgleichungen.
9 Zellen Lektion Nummer 47 Thema: „Genetische Beziehung von Me, NeMe und ihren Verbindungen“.
Ziele und Zielsetzungen des Unterrichts:
Verstehen Sie das Konzept der genetischen Verbindung.
Erfahren Sie, wie Sie genetische Serien aus Metallen und Nichtmetallen erstellen.
Bringen Sie die Studierenden auf der Grundlage des Wissens der Studierenden über die Hauptklassen anorganischer Stoffe zum Konzept der „genetischen Verbindung“ und der genetischen Reihe von Metallen und Nichtmetallen;
Festigung des Wissens über die Nomenklatur und Eigenschaften von Stoffen, die verschiedenen Klassen angehören;
Entwickeln Sie Fähigkeiten, um das Wesentliche hervorzuheben, zu vergleichen und zu verallgemeinern; Beziehungen identifizieren und aufbauen;
Entwickeln Sie Vorstellungen über die Ursache-Wirkungs-Beziehungen von Phänomenen.
Die Konzepte einfacher und komplexer Materie, von Metallen und Nichtmetallen sowie der Hauptklassen anorganischer Verbindungen im Gedächtnis wiederherstellen;
Um Kenntnisse über die genetische Beziehung und die genetische Reihe zu erlangen, lernen Sie, wie man die genetische Reihe von Metallen und Nichtmetallen zusammensetzt.
Entwickeln Sie die Fähigkeit, Fakten zu verallgemeinern, Analogien aufzubauen und Schlussfolgerungen zu ziehen;
Entwickeln Sie weiterhin eine Kommunikationskultur und die Fähigkeit, Ihre Ansichten und Urteile auszudrücken.
Entwickeln Sie ein Verantwortungsbewusstsein für das erworbene Wissen.
Geplante Ergebnisse:
Wissen Definitionen und Klassifizierung anorganischer Stoffe.
In der Lage sein anorganische Stoffe nach Zusammensetzung und Eigenschaften klassifizieren; bilden die genetische Reihe von Metall und Nichtmetall;
veranschaulichen die genetische Beziehung zwischen den Hauptklassen anorganischer Verbindungen mit den Gleichungen chemischer Reaktionen.
Kompetenzen:
kognitive Fähigkeiten : Informationen aus schriftlichen und mündlichen Quellen systematisieren und klassifizieren.
Aktivitätsfähigkeiten : über die eigenen Aktivitäten nachdenken, nach dem Algorithmus handeln, in der Lage sein, selbst einen Algorithmus zu verfassen neue Aktivität, zugänglich für Algorithmisierung; die Sprache der Diagramme verstehen.
Kommunikationsfähigkeit : Kommunikation mit anderen Menschen aufbauen – einen Dialog zu zweit führen, Gemeinsamkeiten und Unterschiede in den Positionen berücksichtigen, mit Partnern interagieren, um ein gemeinsames Produkt und Ergebnis zu erzielen.
Unterrichtsart:
für didaktische Zwecke: eine Lektion zur Wissensaktualisierung;
nach der Organisationsmethode: Verallgemeinerung mit Aufnahme neuen Wissens (Kombinationsunterricht).
Während des Unterrichts
I. Organisatorischer Moment.
II. Aktualisierung der Grundkenntnisse und Handlungsweisen der Studierenden.
Unterrichtsmotto:"Der einzige Weg,
„Zu Wissen führt Aktivität“ (B. Shaw). Folie 1
Im ersten Unterrichtsabschnitt aktualisiere ich das Grundwissen, das zur Lösung des Problems notwendig ist. Dies bereitet die Studierenden auf die Wahrnehmung des Problems vor. Ich führe die Arbeit auf unterhaltsame Weise durch. Ich führe ein „Brainstorming“ zum Thema: „Hauptklassen anorganischer Verbindungen“ durch. Arbeite an Karten
Aufgabe 1. „Drittes Extra“ Folie 2
Den Schülern wurden Karten ausgehändigt, auf denen drei Formeln standen, von denen eine überflüssig war.
Die Schüler identifizieren die zusätzliche Formel und erklären, warum sie überflüssig ist.
Antworten: MgO, Na 2 SO 4, H 2 S Folie 3
Aufgabe 2. „Nennen Sie uns und wählen Sie uns“ („Nennen Sie uns“) Folie 4
| Nichtmetalle | Hydroxide | Anoxische Säuren |
Geben Sie den Namen des ausgewählten Stoffes an („4-5“ notieren Sie die Antworten mit Formeln, „3“ mit Wörtern).
(Die Schüler arbeiten zu zweit und wünschen sich etwas an der Tafel. („4-5“ schreiben die Antworten in Formeln auf, „3“ in Worten).
Antworten: Folie 5
1. Kupfer, Magnesium;
4. Phosphorsäure;
5. Magnesiumcarbonat, Natriumsulfat
7. Salz
III. Neues Material lernen.
1. Festlegung des Unterrichtsthemas gemeinsam mit den Schülern.
Durch chemische Umwandlungen werden Stoffe einer Klasse in Stoffe einer anderen Klasse umgewandelt: von eine einfache Substanz Es entsteht ein Oxid, aus einem Oxid entsteht eine Säure, aus einer Säure entsteht ein Salz. Mit anderen Worten: Die von Ihnen untersuchten Verbindungsklassen sind miteinander verbunden. Teilen wir die Stoffe entsprechend der Komplexität der Zusammensetzung in Klassen ein, beginnend mit einem einfachen Stoff, nach unserem Schema.
Die Schüler äußern ihre Versionen, dank derer wir komponieren einfache Schaltungen 2 Reihen: Metalle und Nichtmetalle. Schema der genetischen Reihe.
Ich mache die Schüler darauf aufmerksam, dass jede Kette etwas gemeinsam hat – das sind die chemischen Elemente Metall und Nichtmetall, die (wie durch Vererbung) von einem Stoff zum anderen übergehen.
(für starke Schüler) CaO, P 2 O 5, MgO, P, H 3 PO 4, Ca, Na 3 PO 4, Ca (OH) 2, NaOH, CaCO 3, H 2 SO 4
(Für schwache Schüler) CaO, CO 2 , C, H 2 CO 3 , Ca, Ca(OH) 2 , CaCO 3 Folie 6
Antworten: Folie 7
P P2O5 H3PO4 Na3 PO4
Ca CaO Ca(OH)2 CaCO3
Wie heißt der Träger der Erbinformation in der Biologie? (Gen).
Welches Element wird Ihrer Meinung nach das „Gen“ für jede Kette sein? (Metall und Nichtmetall).
Daher werden solche Ketten oder Reihen als genetisch bezeichnet. Das Thema unserer Lektion ist „Genetische Verbindung von Me und NeMe“ Folie 8. Öffnen Sie Ihr Notizbuch und notieren Sie Datum und Thema der Lektion. Was ist Ihrer Meinung nach der Zweck unserer Lektion? Machen Sie sich mit dem Konzept der „genetischen Verbindung“ vertraut. Lernen Sie, die genetische Reihe von Metallen und Nichtmetallen zusammenzustellen.
2. Definieren wir die genetische Verbindung.
genetische Verbindung - nennt man die Bindung zwischen Stoffen verschiedene Klassen, die auf ihren gegenseitigen Transformationen basieren und die Einheit ihres Ursprungs widerspiegeln. Folie 9,10
Merkmale, die die genetische Serie charakterisieren: Folie 11
1. Stoffe verschiedener Klassen;
2. Verschiedene Stoffe, die aus einem chemischen Element bestehen, d. h. vertreten verschiedene Formen die Existenz eines Elements;
3. Verschiedene Stoffe eines chemischen Elements sind durch gegenseitige Umwandlungen verbunden.
3. Betrachten Sie Beispiele für die genetische Verwandtschaft von Mir.
2. Eine genetische Reihe, bei der eine unlösliche Base als Base fungiert, dann kann die Reihe durch eine Kette von Transformationen dargestellt werden: Folie 12
Metall→basisches Oxid→Salz→unlösliche Base→basisches Oxid→Metall
Zum Beispiel Cu→CuO→CuCl2→Cu(OH)2→CuO
1. 2 Cu + O 2 → 2 CuO 2. CuO + 2HCI → CuCI 2 3. CuCI 2 + 2NaOH → Cu (OH) 2 + 2NaCI
4. Сu (OH) 2 CuO + H 2 O
4. Betrachten Sie Beispiele für die genetische Verbindung von NeMe.
Auch bei den Nichtmetallen lassen sich zwei Arten von Reihen unterscheiden: Folie 13
2. Die genetische Reihe der Nichtmetalle, bei der eine lösliche Säure als Bindeglied in der Reihe fungiert. Die Transformationskette kann wie folgt dargestellt werden: Nichtmetall → Säureoxid → lösliche Säure → Salz Zum Beispiel P → P 2 O 5 → H 3 PO 4 → Ca 3 (PO 4) 2
1. 4P + 5O 2 → 2P 2 O 5 2. P 2 O 5 + H 2 O → 2H 3 PO 4 3. 2H 3 PO 4 +3 Ca (OH) 2 → Ca 3 (PO 4) 2 +6 H 2 O
5. Zusammenstellung der genetischen Serie. Folie 14
1. Eine genetische Serie, in der Alkali als Base fungiert. Diese Reihe kann durch die folgenden Transformationen dargestellt werden: Metall → basisches Oxid → Alkali → Salz
O 2, + H 2 O, + HCI
4K + O 2 = 2K 2 O K 2 O + H 2 O = 2KOH KOH + HCI = KCl Folie 15
2. Die genetische Reihe der Nichtmetalle, wobei eine unlösliche Säure als Bindeglied in der Reihe fungiert:
Nichtmetall→Säureoxid→Salz→Säure→Säureoxid→Nichtmetall
Zum Beispiel Si→SiO 2 →Na 2 SiO 3 →H 2 SiO 3 →SiO 2 →Si (stellen Sie Gleichungen selbst auf, wer arbeitet „4-5“). Selbsttest. Alle Gleichungen sind richtig „5“, ein Fehler „4“, zwei Fehler „3“.
5. Durchführung von Differentialübungen (Selbstprüfung). Folie 15
Si + O 2 = SiO 2 SiO 2 + 2NaOH = Na 2 SiO 3 + H 2 O Na 2 SiO 3 + 2НCI = H 2 SiO 3 + 2NaCI H 2 SiO 3 = SiO 2 + H 2 O
SiO 2 +2Mg = Si + 2MgO
1. Transformationen nach Schema durchführen. (Aufgabe „4-5“)
Aufgabe 1. Verbinden Sie in der Abbildung die Formeln der Stoffe mit Linien entsprechend ihrer Lage in der genetischen Reihe von Aluminium. Schreiben Sie Reaktionsgleichungen. Folie 16
Selbsttest.
4AI + 3O 2 = 2AI 2 O 3 AI 2 O 3 + 6HCI = 2AICI 3 + 3H 2 O AICI 3 + 3NaOH = AI (OH) 3 + 3NaCI
AI(OH) 3 = AI 2 O 3 + H 2 O Folie 17
Aufgabe 2. „Treffen Sie das Ziel.“ Wählen Sie die Formeln der Substanzen aus, aus denen die genetische Reihe von Kalzium besteht. Schreiben Sie die Reaktionsgleichungen für diese Transformationen. Folie 18

Selbsttest.
2Ca + O 2 = 2CaO CaO + H 2 O = Ca (OH) 2 Ca (OH) 2 +2 HCI = CaCI 2 + 2 H 2 O CaCI 2 + 2AgNO 3 = Ca (NO 3) 2 + 2AgCI Folie 19
2. Führen Sie die Aufgabe gemäß dem Schema aus. Schreiben Sie die Reaktionsgleichungen für diese Transformationen.
O 2 + H 2 O + NaOH
S SO 2 H 2 SO 3 Na 2 SO 3 oder Light-Version
S + O 2 = SO 2 + H 2 O = H 2 SO 3 + NaOH =
SO 2 + H 2 O \u003d H 2 SO 3
H 2 SO 3 + 2NaOH \u003d Na 2 SO 3 + 2H 2 O
IV. VerankerungZUN
Variante 1.
Teil A.
1. Die genetische Reihe des Metalls ist: a) Stoffe, die eine Reihe auf Basis eines Metalls bilden
A)CO 2 b) CO c) CaO d) O 2
3. Bestimmen Sie den Stoff „Y“ aus dem Transformationsschema: Na → Y→NaOH A)N / A 2 Ö b) Na 2 O 2 c) H 2 O d) Na
4. Im Transformationsschema: CuCl 2 → A → B → Cu lauten die Formeln der Zwischenprodukte A und B: a) CuO und Cu (OH) 2 b) CuSO 4 und Cu (OH) 2 c) CuCO 3 und Cu (OH) 2 G)Cu(Oh) 2 UndCuO
5. Das Endprodukt in der Transformationskette basierend auf Kohlenstoffverbindungen CO 2 → X 1 → X 2 → NaOH a) Natriumcarbonat b) Natriumbicarbonat, c) Natriumcarbid, d) Natriumacetat
E → E 2 O 5 → H 3 EO 4 → Na 3 EO 4 a) N b) Mn V)P d)Cl
Teil B.
Fe + Cl 2 A) FeCl 2
Fe + HCl B) FeCl 3
FeO + HCl B) FeCl 2 + H 2
Fe 2 O 3 + HCl D) FeCl 3 + H 2
E) FeCl 2 + H 2 O
E) FeCl 3 + H 2 O
1 B, 2 A, 3D, 4E
a) Kaliumhydroxid (Lösung) b) Eisen c) Bariumnitrat (Lösung) d) Aluminiumoxid
e) Kohlenmonoxid (II) f) Natriumphosphat (Lösung)
Teil C.
1. Implementieren Sie das Schema der Stoffumwandlung: Fe → FeO → FeCl 2 → Fe (OH) 2 → FeSO 4
2Fe + O 2 = 2FeO FeO + 2HCI = FeCI 2 + H 2 O FeCI 2 + 2NaOH = Fe (OH) 2 + 2NaCI
Fe(OH) 2 + H 2 SO 4= FeSO 4 +2 H 2 O
Möglichkeit 2.
Teil A. (Fragen mit einer richtigen Antwort)
b) Stoffe, die eine Reihe auf der Grundlage eines Nichtmetalls bilden. c) Stoffe, die eine Reihe auf der Grundlage eines Metalls oder Nichtmetalls bilden. d) Stoffe aus verschiedenen Stoffklassen, die durch Umwandlungen verbunden sind
2. Bestimmen Sie den Stoff „X“ aus dem Transformationsschema: P → X → Ca 3 (PO 4) 2 A)P 2 Ö 5 b) P 2 O 3 c) CaO d) O 2
a) Ca B)CaO c) CO 2 d) H 2 O
4. Im Umwandlungsschema: MgCl 2 → A → B → Mg lauten die Formeln der Zwischenprodukte A und B: a) MgO und Mg (OH) 2 b) MgSO 4 und Mg (OH) 2 c) MgCO 3 und Mg (OH) 2 G)mg(Oh) 2 UndMgO
CO 2 → X 1 → X 2 → NaOH a) Natriumcarbonat b) Natriumbicarbonat
6. Element „E“, das an der Transformationskette teilnimmt:
Teil B. (Aufgaben mit 2 oder mehr die richtigen Optionen antworten)
1. Stellen Sie eine Übereinstimmung zwischen den Formeln der Ausgangsstoffe und den Reaktionsprodukten her:
Formeln von Ausgangsstoffen, Formeln von Produkten
NaOH + CO 2 A) NaOH + H 2
Na + H 2 O B) NaHCO 3
NaOH + HCl D) NaCl + H 2 O
1B, 2V, 3A, 4G
a) Natriumhydroxid (Lösung) b) Sauerstoff c) Natriumchlorid (Lösung) d) Calciumoxid
e) Kaliumpermanganat (kristallin) e) Schwefelsäure
Teil C. (mit erweiterter Antwort)
S + O 2 = SO 2 2SO 2 + O 2 = 2 SO 3 SO 3 + H 2 O = H 2 SO 4 H 2 SO 4 + Ca (OH) 2 = CaSO 4 +2 H 2 O
CaSO 4 + BaCI 2 = BaSO 4 + CaCI 2
v.ErgebnisseLektion. Benotung.
VI.D/Z S.215-216 Vorbereitung auf Projekt Nr. 3 Option 1 von Aufgabe Nr. 2,4, 6, Option 2 von Aufgabe Nr. 2,3, 6. Folie 20
VII. Betrachtung.
Die Schüler schreiben auf Papier, was sie gut gemacht haben und was nicht. Was waren die Schwierigkeiten? Und ein Wunsch an den Lehrer.
Die Lektion ist beendet. Vielen Dank an alle und einen schönen Tag noch. Folie 21
Wenn es Zeit gibt.
Aufgabe
Einst führte Yuh Experimente durch, um die elektrische Leitfähigkeit von Lösungen verschiedener Salze zu messen. Auf seinem Labortisch standen Chemiebecher mit Lösungen. KCl, BaCl
2
, K
2
CO
3
, N / A
2
SO
4
und AgNO
3
. Jedes Glas war ordentlich beschriftet. Es gab einen Papagei im Labor, dessen Käfig nicht sehr gut verschlossen werden konnte. Als Juh, vertieft in das Experiment, auf das verdächtige Rascheln zurückblickte, stellte er mit Entsetzen fest, dass der Papagei unter grober Verletzung der Sicherheitsvorschriften versuchte, aus einem Glas BaCl 2 -Lösung zu trinken. Da Yuh wusste, dass alle löslichen Bariumsalze äußerst giftig sind, schnappte er sich schnell ein Glas mit einem anderen Etikett vom Tisch und schüttete die Lösung gewaltsam in den Schnabel des Papageis. Der Papagei wurde gerettet. Welches Glas Lösung wurde verwendet, um den Papagei zu retten?
Antworten:
BaCl 2 + Na 2 SO 4 = BaSO 4 (Niederschlag) + 2NaCl (Bariumsulfat ist so schwer löslich, dass es nicht giftig sein kann, wie einige andere Bariumsalze).
Anhang 1
9 „B“-Klasse F.I.______________________________ (für schwache Schüler)
Aufgabe 1. „Das dritte Extra“.
(4 richtig – „5“, 3 – „4“, 2 – „3“, 1 – „2“)
| Nichtmetalle | Hydroxide | Anoxische Säuren |
||||
Die Studierenden definieren die gewählte Klasse und wählen aus dem bereitgestellten Handout die entsprechenden Stoffe aus.
Kupfer, Siliziumoxid, Salzsäure, Bariumhydroxid, Kohle, Magnesium, Phosphorsäure, Bariumhydroxid, Magnesiumoxid, Eisen(III)-hydroxid, Magnesiumcarbonat, Natriumsulfat.
(„4-5“ notieren Sie die Antworten mit Formeln, „3“ mit Wörtern).
12 Antworten „5“, 11-10 – „4“, 9-8 – „3“, 7 oder weniger – „2“
Aufgabe 3.
O 2, + H 2 O, + HCI
Zum Beispiel K → K 2 O → KOH → KCl (Gleichungen selbst erstellen, wer arbeitet „3“, ein Fehler „3“, zwei Fehler „2“).
Aufgabe 4. Führen Sie die Aufgabe gemäß dem Schema aus. Schreiben Sie die Reaktionsgleichungen für diese Transformationen.
O 2 + H 2 O + NaOH
S SO 2 H 2 SO 3 Na 2 SO 3
oder Light-Version
H 2 SO 3 + NaOH \u003d
Variante 1.
Teil A. (Fragen mit einer richtigen Antwort)
1. Die genetische Reihe eines Metalls besteht aus: a) Stoffen, die eine Reihe basierend auf einem Metall bilden
b) Stoffe, die eine Reihe auf der Grundlage eines Nichtmetalls bilden. c) Stoffe, die eine Reihe auf der Grundlage eines Metalls oder Nichtmetalls bilden. d) Stoffe aus verschiedenen Stoffklassen, die durch Umwandlungen verbunden sind
2. Bestimmen Sie den Stoff „X“ aus dem Transformationsschema: C → X → CaCO 3
a) CO 2 b) CO c) CaO d) O 2
3. Bestimmen Sie den Stoff „Y“ aus dem Transformationsschema: Na → Y→NaOH a) Na 2 O b) Na 2 O 2 c) H 2 O d) Na
4. Im Transformationsschema: CuCl 2 → A → B → Cu lauten die Formeln der Zwischenprodukte A und B: a) CuO und Cu (OH) 2 b) CuSO 4 und Cu (OH) 2 c) CuCO 3 und Cu (OH) 2 g) Cu(OH) 2 und CuO
5. Das Endprodukt in der Transformationskette basierend auf Kohlenstoffverbindungen CO 2 → X 1 → X 2 → NaOH a) Natriumcarbonat b) Natriumbicarbonat c) Natriumcarbid d) Natriumacetat
6. Element „E“, das an der Transformationskette beteiligt ist: E → E 2 O 5 → H 3 EO 4 → Na 3 EO 4 a) N b) Mn c) P d) Cl
Teil B. (Aufgaben mit 2 oder mehr richtigen Antworten)
1. Stellen Sie eine Übereinstimmung zwischen den Formeln der Ausgangsstoffe und den Reaktionsprodukten her:
Formeln von Ausgangsstoffen, Formeln von Produkten
Fe + Cl 2 A) FeCl 2
Fe + HCl B) FeCl 3
FeO + HCl B) FeCl 2 + H 2
Fe 2 O 3 + HCl D) FeCl 3 + H 2
E) FeCl 2 + H 2 O
E) FeCl 3 + H 2 O
2. Eine Lösung von Kupfersulfat (II) interagiert:
a) Kaliumhydroxid (Lösung) b) Eisen c) Bariumnitrat (Lösung) d) Aluminiumoxid
e) Kohlenmonoxid (II) f) Natriumphosphat (Lösung)
Teil C. (mit erweiterter Antwort)
1. Implementieren Sie ein Schema zur Umwandlung von Stoffen:
Fe → FeO → FeCI 2 → Fe(OH) 2 → FeSO 4
Anlage 2
9 „B“-Klasse F.I.______________________________ (für einen starken Schüler)
Aufgabe 1. „Das dritte Extra“. Identifizieren Sie die redundante Formel und erklären Sie, warum sie redundant ist.
(4 richtig – „5“, 3 – „4“, 2 – „3“, 1 – „2“)
Aufgabe 2. „Nennen Sie uns und wählen Sie uns“ („Nennen Sie uns“). Geben Sie den Namen des ausgewählten Stoffes ein und füllen Sie die Tabelle aus.
Die Studierenden definieren die gewählte Klasse und wählen aus dem bereitgestellten Handout die entsprechenden Stoffe aus.
Kupfer, Siliziumoxid, Salzsäure, Bariumhydroxid, Kohle, Magnesium, Phosphorsäure, Bariumhydroxid, Magnesiumoxid, Eisen(III)-hydroxid, Magnesiumcarbonat, Natriumsulfat. („4-5“ notieren Sie die Antworten mit Formeln, „3“ mit Wörtern).
12 Antworten „5“, 11-10 – „4“, 9-8 – „3“, 7 oder weniger – „2“
Aufgabe 3.
Si→SiO 2 →Na 2 SiO 3 →H 2 SiO 3 →SiO 2 →Si (Stellen Sie die Gleichungen selbst auf, wer arbeitet „4-5“). Selbsttest. Alle Gleichungen sind richtig „5“, ein Fehler „4“, zwei Fehler „3“.
Aufgabe 4. Verbinden Sie in der Abbildung die Formeln der Stoffe mit Linien entsprechend ihrer Lage in der genetischen Reihe von Aluminium. Schreiben Sie Reaktionsgleichungen. Alle Gleichungen sind richtig „5“, ein Fehler „4“, zwei Fehler „3“.
Aufgabe 5. „Treffen Sie das Ziel.“ Wählen Sie die Formeln der Substanzen aus, aus denen die genetische Reihe von Kalzium besteht. Schreiben Sie die Reaktionsgleichungen für diese Transformationen. Alle Gleichungen sind richtig „5“, ein Fehler „4“, zwei Fehler „3“.

Option 2.
Teil A. (Fragen mit einer richtigen Antwort)
1. Die genetische Reihe eines Nichtmetalls besteht aus: a) Stoffen, die eine Reihe basierend auf einem Metall bilden
b) Stoffe, die eine Reihe auf der Grundlage eines Nichtmetalls bilden. c) Stoffe, die eine Reihe auf der Grundlage eines Metalls oder Nichtmetalls bilden. d) Stoffe aus verschiedenen Stoffklassen, die durch Umwandlungen verbunden sind
2. Bestimmen Sie den Stoff „X“ aus dem Transformationsschema: P → X → Ca 3 (PO 4) 2 a) P 2 O 5 b) P 2 O 3 c) CaO d) O 2
3. Bestimmen Sie den Stoff „Y“ aus dem Transformationsschema: Ca → Y→Ca(OH) 2
a) Ca b) CaO c) CO 2 d) H 2 O
4. Im Umwandlungsschema: MgCl 2 → A → B → Mg lauten die Formeln der Zwischenprodukte A und B: a) MgO und Mg (OH) 2 b) MgSO 4 und Mg (OH) 2 c) MgCO 3 und Mg (OH) 2 g) Mg (OH) 2 und MgO
5. Das Endprodukt der auf Kohlenstoffverbindungen basierenden Umwandlungskette:
CO 2 → X 1 → X 2 → NaOH a) Natriumcarbonat b) Natriumbicarbonat
c) Natriumcarbid d) Natriumacetat
6. Element „E“, das an der Transformationskette teilnimmt:
E → EO 2 → EO 3 → H 2 EO 4 → Na 2 EO 4 a) N b) S c) P d) Mg
Teil B. (Aufgaben mit 2 oder mehr richtigen Antworten)
1. Stellen Sie eine Übereinstimmung zwischen den Formeln der Ausgangsstoffe und den Reaktionsprodukten her:
Formeln von Ausgangsstoffen, Formeln von Produkten
NaOH + CO 2 A) NaOH + H 2
NaOH + CO 2 B) Na 2 CO 3 + H 2 O
Na + H 2 O B) NaHCO 3
NaOH + HCl D) NaCl + H 2 O
2. Salzsäure hat keine Wechselwirkungen:
a) Natriumhydroxid (Lösung) b) Sauerstoff c) Natriumchlorid (Lösung) d) Calciumoxid
e) Kaliumpermanganat (kristallin) f) Schwefelsäure
Teil C. (mit erweiterter Antwort)
Implementieren Sie das Schema der Stoffumwandlung: S → SO 2 → SO 3 → H 2 SO 4 → CaSO 4 → BaSO 4
Anhang 3
Antwortbogen „4-5“:
Aufgabe 1. MgO, Na 2 SO 4, H 2 S
Aufgabe 2.
1. Kupfer, Magnesium;
3. Siliziumoxid, Magnesiumoxid;
4. Phosphorsäure,
5. Magnesiumcarbonat, Sulfat;
6. Bariumhydroxid, Eisen(III)-hydroxid;
7. Natriumhydrochlorid
Aufgabe 3.
SiO 2 + 2NaOH \u003d Na 2 SiO 3 + H 2 O
Na 2 SiO 3 + 2НCI \u003d H 2 SiO 3 + 2NaCI
H 2 SiO 3 \u003d SiO 2 + H 2 O
SiO 2 +2Mg = Si + 2MgO
Aufgabe 4.
4AI + 3O 2 \u003d 2AI 2 O 3
AI 2 O 3 + 6HCI \u003d 2AICI 3 + 3H 2 O
AICI 3 + 3NaOH \u003d AI (OH) 3 + 3NaCI
AI (OH) 3 \u003d AI 2 O 3 + H 2 O
Aufgabe 5.
CaO + H 2 O \u003d Ca (OH) 2
Ca (OH) 2 +2 HCI \u003d CaCI 2 + 2 H 2 O
CaCI 2 + 2AgNO 3 = Ca (NO 3) 2 + 2AgCI
Selbsteinschätzungsbogen.
| Vollständiger Name des Studenten | Auftragsnummer | |