Металл ба металл бус генетикийн цуврал. Генетикийн холбоо Генетикийн цуврал гэдэг нь нэг элементийн нэгдэл бөгөөд харилцан хувиргалтаар холбогдсон янз бүрийн ангиллын бодисуудыг нэгтгэдэг хэлхээ юм.
Металл ба тэдгээрийн нэгдлүүдийн генетикийн цуваа
Ийм эгнээ бүр нь метал, түүний үндсэн исэл, суурь, ижил металлын аливаа давсаас бүрдэнэ.
Эдгээр бүх цувралд металаас үндсэн исэлд шилжихийн тулд хүчилтөрөгчтэй нийлмэл урвалыг ашигладаг, жишээлбэл:
2Ca + O 2 = 2CaO; 2Mg + O 2 = 2MgO;
Эхний хоёр эгнээний үндсэн оксидуудаас суурь руу шилжих шилжилтийг танд мэдэгдэж байгаа чийгшүүлэх урвалаар гүйцэтгэдэг, жишээлбэл:
CaO + H 2 O = Ca (OH) 2.
Сүүлийн хоёр эгнээний хувьд тэдгээрт агуулагдах MgO ба FeO исэлүүд устай урвалд ордоггүй. Ийм тохиолдолд суурийг олж авахын тулд эдгээр ислийг эхлээд давс болгон хувиргаж, дараа нь тэдгээрийг суурь болгон хувиргадаг. Тиймээс, жишээлбэл, MgO исэлээс гидроксид Mg (OH) 2 руу шилжихийн тулд дараалсан урвалуудыг ашигладаг.
MgO + H 2 SO 4 = MgSO 4 + H 2 O; MgSO 4 + 2NaOH = Mg (OH) 2 ↓ + Na 2 SO 4.
Суурьаас давс руу шилжих шилжилт нь танд аль хэдийн мэдэгдэж байсан урвалаар явагддаг. Тиймээс эхний хоёр эгнээний уусдаг суурь (шүлт) нь хүчил, хүчиллэг исэл эсвэл давсны нөлөөн дор давс болж хувирдаг. Сүүлийн хоёр эгнээний уусдаггүй суурь нь хүчилтэй давс үүсгэдэг.
Металл бус металл ба тэдгээрийн нэгдлүүдийн генетикийн цуврал.
Ийм эгнээ бүр нь металл бус, хүчиллэг исэл, харгалзах хүчил ба энэ хүчлийн анионуудыг агуулсан давсаас бүрдэнэ.
Эдгээр бүх цувралд метал бусаас хүчиллэг исэлд шилжихийн тулд хүчилтөрөгчтэй нийлмэл урвалыг ашигладаг, жишээлбэл:
4P + 5O 2 = 2 P 2 O 5; Si + O 2 = SiO 2;
Хүчиллэг ислээс хүчил рүү шилжих эхний гуравэгнээ нь танд мэдэгдэж байгаа чийгшүүлэх урвалаар хийгддэг, жишээлбэл:
P 2 O 5 + 3H 2 O = 2 H 3 PO 4.
Гэсэн хэдий ч сүүлийн эгнээнд агуулагдах SiO 2 исэл нь устай урвалд ордоггүй гэдгийг та мэднэ. Энэ тохиолдолд эхлээд тохирох давс болгон хувиргаж, дараа нь хүссэн хүчилээ олж авна.
SiO 2 + 2KOH = K 2 SiO 3 + H 2 O; K 2 SiO 3 + 2HСl = 2KCl + H 2 SiO 3 ↓.
Хүчилээс давс руу шилжих шилжилтийг үндсэн исэл, шүлт, давстай мэддэг урвалаар хийж болно.
Санаж байна уу:
· Ижил генетикийн цуврал бодисууд бие биетэйгээ урвалд ордоггүй.
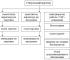
Генетикийн цуврал бодисууд янз бүрийн төрөлбие биедээ хариу үйлдэл үзүүлэх. Ийм урвалын бүтээгдэхүүн нь үргэлж давс байдаг (Зураг 5):
Цагаан будаа. 5. Төрөл бүрийн генетикийн цувралын бодисуудын харилцааны схем.
Энэ диаграмм нь өөр өөр ангиудын хоорондын хамаарлыг харуулаагүй болно органик нэгдлүүдмөн олон янз байдлыг тайлбарладаг химийн урвалтэдний хооронд.
Сэдвийн даалгавар:
Дараах хувиргалтыг хийж болох урвалын тэгшитгэлийг байгуул.
1. Na → Na 2 O → NaOH → Na 2 CO 3 → Na 2 SO 4 → NaOH;
2. P → P 2 O 5 → H 3 PO 4 → K 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4;
3. Ca → CaO → Ca (OH) 2 → CaCl 2 → CaCO 3 → CaO;
4. S → SO 2 → H 2 SO 3 → K 2 SO 3 → H 2 SO 3 → BaSO 3;
5. Zn → ZnO → ZnCl 2 → Zn (OH) 2 → ZnSO 4 → Zn (OH) 2;
6. C → CO 2 → H 2 CO 3 → K 2 CO 3 → H 2 CO 3 → CaCO 3;
7. Al → Al 2 (SO 4) 3 → Al (OH) 3 → Al 2 O 3 → AlCl 3;
8. Fe → FeCl 2 → FeSO 4 → Fe (OH) 2 → FeO → Fe 3 (PO 4) 2;
9. Si → SiO 2 → H 2 SiO 3 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2;
10. Mg → MgCl 2 → Mg (OH) 2 → MgSO 4 → MgCO 3 → MgO;
11. K → KOH → K 2 CO 3 → KCl → K 2 SO 4 → KOH;
12. S → SO 2 → CaSO 3 → H 2 SO 3 → SO 2 → Na 2 SO 3;
13. S → H 2 S → Na 2 S → H 2 S → SO 2 → K 2 SO 3;
14. Cl 2 → HCl → AlCl 3 → KCl → HCl → H 2 CO 3 → CaCO 3;
15. FeO → Fe (OH) 2 → FeSO 4 → FeCl 2 → Fe (OH) 2 → FeO;
16. CO 2 → K 2 CO 3 → CaCO 3 → CO 2 → BaCO 3 → H 2 CO 3;
17. K 2 O → K 2 SO 4 → KOH → KCl → K 2 SO 4 → KNO 3;
18. P 2 O 5 → H 3 PO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → H 3 PO 4 → H 2 SO 3;
19. Al 2 O 3 → AlCl 3 → Al (OH) 3 → Al (NO 3) 3 → Al 2 (SO 4) 3 → AlCl 3;
20. SO 3 → H 2 SO 4 → FeSO 4 → Na 2 SO 4 → NaCl → HCl;
21. KOH → KCl → K 2 SO 4 → KOH → Zn (OH) 2 → ZnO;
22. Fe (OH) 2 → FeCl 2 → Fe (OH) 2 → FeSO 4 → Fe (NO 3) 2 → Fe;
23. Mg (OH) 2 → MgO → Mg (NO 3) 2 → MgSO 4 → Mg (OH) 2 → MgCl 2;
24. Al (OH) 3 → Al 2 O 3 → Al (NO 3) 3 → Al 2 (SO 4) 3 → AlCl 3 → Al (OH) 3;
25. H 2 SO 4 → MgSO 4 → Na 2 SO 4 → NaOH → NaNO 3 → HNO 3;
26. HNO 3 → Ca (NO 3) 2 → CaCO 3 → CaCl 2 → HCl → AlCl 3;
27. CuCO 3 → Cu (NO 3) 2 → Cu (OH) 2 → CuO → CuSO 4 → Cu;
28. MgSO 4 → MgCl 2 → Mg (OH) 2 → MgO → Mg (NO 3) 2 → MgCO 3;
29. K 2 S → H 2 S → Na 2 S → H 2 S → SO 2 → K 2 SO 3;
30. ZnSO 4 → Zn (OH) 2 → ZnCl 2 → HCl → AlCl 3 → Al (OH) 3;
31. Na 2 CO 3 → Na 2 SO 4 → NaOH → Cu (OH) 2 → H 2 O → HNO 3;
Генетик холбоосЯнз бүрийн ангилалд хамаарах бодисуудын хоорондын хамаарал юм.
Генетикийн цувралын гол шинж тэмдгүүд:
1. Нэг цувралын бүх бодисууд нэг химийн элементээр үүсгэгдсэн байх ёстой.
2. Нэг элементээс үүссэн бодисууд нь химийн бодисын өөр өөр ангилалд хамаарах ёстой.
3. Элементийн удамшлын шугамыг бүрдүүлдэг бодисууд нь харилцан хөрвүүлэх замаар харилцан уялдаатай байх ёстой.
Тиймээс, генетикОрганик бус нэгдлүүдийн янз бүрийн ангиллыг төлөөлдөг, ижил химийн элементийн нэгдлүүд, харилцан хувирч, эдгээр бодисын нийтлэг гарал үүслийг тусгасан хэд хэдэн бодис гэж нэрлэдэг.
Металлын хувьд генетикийн холбоотой гурван эгнээ, металл бус бодисын хувьд нэг эгнээ байдаг.
1. Гидроксид нь суурь (шүлт) болох металлын генетикийн хүрээ:
металл→үндсэн оксид→суурь (шүлт)→давс.
Жишээлбэл, кальцийн генетикийн бүтэц:
Ca → CaO → Ca (OH) 2 → CaCl 2
2. Амфотерийн гидроксид үүсгэдэг металлын генетикийн хүрээ:
давс
металл→амфотерийн исэл→(давс)→амфотерийн гидроксид
Жишээ нь: ZnCl 2
Zn → ZnO → ZnSO 4 → Zn (OH) 2
(H 2 ZnO 2) ↓
Na 2 ZnO 2
Цайрын исэл нь устай харьцдаггүй тул эхлээд давс, дараа нь цайрын гидроксидыг гаргаж авдаг. Хэрэв метал нь уусдаггүй суурьтай тохирч байвал ижил зүйлийг хийнэ.
3. Металл бус металлын генетикийн хүрээ (металл бус зөвхөн хүчиллэг исэл үүсгэдэг):
металл бус→хүчиллэг исэл→хүчил→давс
Жишээлбэл, фосфорын генетик шугам:
P → P 2 O 5 → H 3 PO 4 → K 3 PO 4
Нэг бодисоос нөгөөд шилжих нь химийн урвалын тусламжтайгаар явагддаг.
"12-р ангийн ерөнхий хими" захидал харилцааны оюутнуудад зориулсан заавар 1. Оюутны ангилал: Энэхүү илтгэлийн материалыг оюутанд өгсөн болно. бие даан суралцах 12-р ангийн ерөнхий химийн хичээлээс "Бодис ба тэдгээрийн шинж чанар" сэдвүүд. 2. Хичээлийн агуулга: сэдвийн 5 илтгэлийг багтаана. Судалгааны сэдэв бүр тодорхой бүтэцтэй байдаг сургалтын материалтодорхой сэдвээр, сүүлчийн слайд нь хяналтын тест юм - өөрийгөө хянах даалгавар. 3. Энэ курсын сургалтын үргэлжлэх хугацаа: долоо хоногоос хоёр сар хүртэл (дангаар нь тодорхойлно). 4. Мэдлэгийн хяналт: оюутан тестийн даалгаврын хэрэгжилтийн тайланг - сэдвийг харуулсан даалгаврын сонголт бүхий хуудас өгдөг. 5. Үр дүнгийн үнэлгээ: "3" - гүйцэтгэлийн 50%, "4" - 75%, "5"% даалгавар. 6. Сургалтын үр дүн: судалсан сэдвээ тэнцсэн (унасан).


Урвалын тэгшитгэл: 1.2Cu + о 2 2CuO зэс (II) исэл 2. CuO + 2 HCl CuCl 2 + Н 2 О зэс (II) хлорид 3. CuCl NaOH Cu (OH) Na Cl зэс (II) гидроксид 4. Cu ( OH) 2 + H 2 SO 4 CuSO 4 + 2H 2 O зэс (II) сульфат



Органик нэгдлүүдийн генетикийн хүрээ. Хэрэв органик бус химийн генетикийн цувралын үндэс нь нэг химийн элементээс үүссэн бодисууд байдаг бол органик химийн генетикийн цувралын үндэс нь дараахь бодисуудаас бүрддэг. ижил тоомолекул дахь нүүрстөрөгчийн атомууд.

Урвалын схем: Сум дээрх тоо бүр нь тодорхой урвалын тэгшитгэлтэй тохирч байна: этанал этанол этан этан хлорэтан этин Цууны (этан) хүчил

Урвалын тэгшитгэл: 1. С 2 Н 5 Cl + H 2 O С 2 Н 5 OH + HCl 2. С 2 Н 5 OH + O СН 3 СН O + H 2 O 3. СН 3 СН O + H 2 С 2 Н 5 OH 4.C 2 H 5 OH + HCl C 2 H 5 Cl + H 2 O 5. C 2 H 5 Cl C 2 H 4 + HCl 6. C 2 H 4 C 2 H 2 + H 2 7. C 2 H 2 + H 2 O CH 3 CH O 8. CH 3 CH O + Ag 2 O CH 3 COOH + Ag

Давталт. Органик бус нэгдлүүдийн ангиллын генетикийн хамаарал
Танилцуулга
Энэ хичээлийн сэдэв нь “Давталт. Органик бус нэгдлүүдийн ангиллын генетикийн хамаарал. Та бүх органик бус бодисууд хэрхэн хуваагддагийг давтаж, органик бус нэгдлүүдийн нэг ангиллаас өөр нэгийг яаж авах боломжтойг дүгнэх болно. Хүлээн авсан мэдээлэлд үндэслэн та ийм ангиудын удамшлын холбоо гэж юу болох, ийм харилцааны үндсэн хоёр арга замыг олж мэдэх болно.
Сэдэв: Танилцуулга
Хичээл: Давталт. Органик бус нэгдлүүдийн ангиллын генетикийн хамаарал
Хими бол бодис, тэдгээрийн шинж чанар, бие биенээ хувиргах шинжлэх ухаан юм.
Цагаан будаа. 1. Органик бус нэгдлүүдийн ангиудын генетикийн хамаарал
Бүх органик бус бодисыг дараахь байдлаар хувааж болно.
Энгийн бодисууд
Нарийн төвөгтэй бодисууд.
Энгийн бодисыг дараахь байдлаар хуваана.
Металл
Төмөр бус
Нарийн төвөгтэй бодисыг дараахь байдлаар хувааж болно.
Суурь
Хүчил
Давс. 1-р зургийг үз.
Энэ нь хоёр элементээс бүрдэх хоёртын нэгдэл бөгөөд тэдгээрийн нэг нь -2 исэлдэлтийн төлөвт хүчилтөрөгч юм. Зураг 2.
Жишээлбэл, кальцийн исэл: Ca +2 O -2, фосфорын исэл (V) P 2 O 5., азотын исэл (IV) -« үнэгний сүүл"

Цагаан будаа. 2. Оксид
Үүнд:
Үндсэн
Хүчиллэг
Үндсэн оксидуудхаргалзах үндэслэл.
Хүчиллэг исэлхаргалзах хүчил.
Давсбүрдэнэ металлын катионуудболон хүчлийн үлдэгдэл анионууд.

Цагаан будаа. 3. Бодисын хоорондын генетикийн харилцааны арга замууд
Тиймээс: органик бус нэгдлүүдийн нэг ангиас өөр анги авч болно.
Тиймээс бүгд органик бус бодисын ангиуд хоорондоо холбоотой байдаг.
Ангиудыг холбохорганик бус нэгдлүүдийг ихэвчлэн нэрлэдэг генетик.Зураг 3.
Эхлэл гэдэг нь Грек хэлээр "гарал үүсэл" гэсэн утгатай. Тэдгээр. Генетик холбоос нь бодисын хувирал ба тэдгээрийн нэг бодисоос гарал үүслийн хоорондын хамаарлыг харуулдаг.
Бодисын хооронд генетикийн харилцааны хоёр үндсэн зам байдаг. Тэдний нэг нь металлаар, нөгөө нь металл бусаар эхэлдэг.
Металлын генетикийн хүрээхаруулж байна:
Металл → Үндсэн исэл → Давс → Суурь → Шинэ давс.
Металлын бус генетикийн хүрээийм өөрчлөлтүүдийг тусгасан:
Төмөр бус → Хүчиллэг исэл → Хүчил → Давс.
Аливаа генетикийн цувралын хувьд та харуулсан урвалын тэгшитгэлийг бичиж болно зарим бодисыг бусад болгон хувиргах.
Эхлэхийн тулд та генетикийн цувралын бодис бүр органик бус нэгдлүүдийн аль ангилалд хамаарахыг тодорхойлох хэрэгтэй.
Бодоод үз дээ сумны өмнөх бодисоос түүний араас бодисыг яаж авах вэ.
Жишээ №1. Металлын генетикийн хүрээ.

Цуврал эхэлнэ энгийн бодисметалл зэс. Эхний шилжилтийг хийхийн тулд хүчилтөрөгчийн уур амьсгалд зэсийг шатаах хэрэгтэй.
2Cu + O 2 → 2CuO
Хоёр дахь шилжилт: та давс авах хэрэгтэй CuCl 2. Энэ нь давсны хүчил HCl-ээр үүсгэгддэг, учир нь давсны хүчлийн давсыг хлорид гэж нэрлэдэг.
CuO +2 HCl → CuCl 2 + H 2 O
Гурав дахь алхам: уусдаггүй суурь авахын тулд уусдаг давс руу шүлт нэмэх хэрэгтэй.
CuCl 2 + 2NaOH → Cu (OH) 2 ↓ + 2NaCl
Зэс (II) гидроксидыг зэс (II) сульфат болгон хувиргахын тулд түүнд нэмнэ хүхрийн хүчил H 2 SO 4.
Cu (OH) 2 ↓ + H 2 SO 4 → CuSO 4 + 2H 2 O
Жишээ №2. Металлын бус генетикийн хүрээ.

Цуврал нь энгийн бодис болох металл бус нүүрстөрөгчөөр эхэлдэг. Эхний шилжилтийг хийхийн тулд хүчилтөрөгчийн уур амьсгалд нүүрстөрөгчийг шатаах хэрэгтэй.
C + O 2 → CO 2
Хэрэв та хүчиллэг исэлд ус нэмбэл нүүрстөрөгчийн хүчил гэж нэрлэгддэг хүчил үүсдэг.
CO 2 + H 2 O → H 2 CO 3
Нүүрстөрөгчийн хүчлийн давс - кальцийн карбонатыг авахын тулд та хүчилд кальцийн нэгдэл, жишээлбэл, кальцийн гидроксид Ca (OH) 2 нэмэх хэрэгтэй.
H 2 CO 3 + Ca (OH) 2 → CaCO 3 + 2H 2 O
Аливаа генетикийн цувралын найрлагад янз бүрийн төрлийн органик бус нэгдлүүдийн бодисууд орно.
Гэхдээ эдгээр бодисууд нь нэг элементийг агуулсан байх ёстой. Нэгдлүүдийн ангиллын химийн шинж чанарыг мэдэхийн тулд та эдгээр хувиргалтыг хийх урвалын тэгшитгэлийг сонгож болно. Эдгээр хувиргалтыг зарим бодисыг олж авах хамгийн оновчтой аргыг сонгоход үйлдвэрлэлд ашигладаг.
Та бүх органик бус бодисууд хэрхэн хуваагддагийг давтаж, органик бус нэгдлүүдийн нэг ангиллаас өөр нэгийг яаж авах боломжтойг дүгнэсэн. Хүлээн авсан мэдээлэлд үндэслэн бид ийм ангиудын генетикийн холбоо гэж юу болох, ийм холболтын хоёр үндсэн арга замыг олж мэдсэн. .
1. Rudzitis G.E. Органик бус ба органик хими. 8-р анги: Боловсролын байгууллагад зориулсан сурах бичиг: суурь түвшин/ G.E. Rudzitis, F.G. Фельдман, Москва: Гэгээрэл. 2011 176 он.: Өвчтэй.
2. Попел PP Хими: 8-р анги: Боловсролын байгууллагуудад зориулсан сурах бичиг / PP. Попел, Л.С.Кривля. -К .: Мэдээллийн технологийн академи, 2008.-240 х.: өвчтэй.
3. Габриелян О.С. Хими. 9-р анги. Сурах бичиг. Нийтлэгч: Bustard.: 2001. 224 секунд.
1.No 10-а, 10з (х. 112) Рудзит Г.Е. Органик бус ба органик хими. 8-р анги: Боловсролын байгууллагад зориулсан сурах бичиг: үндсэн түвшин / Г.Е.Рудзитис, Ф.Г. Фельдман, Москва: Гэгээрэл. 2011 176 он: өвчтэй.
2. Кальцийн оксидоос кальцийн сульфатыг хоёр аргаар яаж авах вэ?
3. Хүхэрээс барийн сульфат авах генетикийн хүрээг бүрдүүлнэ. Урвалын тэгшитгэлийг бичнэ үү.