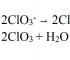Цахилгаан химийн цувралын эхнийх нь хүчдэл юм. Орчин үеийн материалын ертөнц бол металлын хүчдэлийн цахилгаан химийн цуврал юм. I. Тайзны сорилт
Хэд хэдэн хүчдэлээс ямар мэдээлэл авч болох вэ?
Олон тооны металлын стрессийг органик бус химийн салбарт өргөн ашигладаг. Ялангуяа олон урвалын үр дүн, тэр ч байтугай тэдгээрийг хэрэгжүүлэх боломж нь NER дахь тодорхой металлын байрлалаас хамаардаг. Энэ асуудлыг илүү дэлгэрэнгүй авч үзье.
Металлын хүчилтэй харилцан үйлчлэл
Устөрөгчийн зүүн талд байрлах хүчдэлийн цувралд байрлах металлууд нь хүчилтэй урвалд ордог - исэлдүүлэхгүй бодисууд. H-ийн баруун талд байрлах NER-д байрлах металууд нь зөвхөн хүчил - исэлдүүлэгч бодисуудтай (ялангуяа HNO 3 ба төвлөрсөн H 2 SO 4) харилцан үйлчилдэг.
Жишээ 1... Цайр нь NER-д устөрөгчийн зүүн талд байрладаг тул бараг бүх хүчилтэй урвалд орох чадвартай.
Zn + 2HCl = ZnCl 2 + H 2
Zn + H 2 SO 4 = ZnSO 4 + H 2
Жишээ 2... Зэс нь N-ийн баруун талд ERN-д байрладаг; Энэ металл нь "ердийн" хүчлүүдтэй (HCl, H 3 PO 4, HBr, органик хүчил) урвалд ордоггүй, харин исэлдүүлэгч хүчлүүдтэй (азотын, төвлөрсөн хүхрийн) харилцан үйлчилдэг:
Cu + 4HNO 3 (конц.) = Cu (NO 3) 2 + 2NO 2 + 2H 2 O
Cu + 2H 2 SO 4 (конц.) = CuSO 4 + SO 2 + 2H 2 O
Би нэг чухал зүйлд анхаарлаа хандуулж байна: металууд исэлдүүлэгч хүчлүүдтэй харилцан үйлчлэхэд устөрөгч биш, харин бусад нэгдлүүд ялгардаг. Та энэ талаар илүү ихийг уншиж болно!
Металлуудын устай харилцан үйлчлэл
Mg-ийн зүүн талд байрлах хүчдэлийн цувралд байрлах металууд нь устөрөгчийг ялгаруулж, шүлтийн уусмал үүсгэх замаар өрөөний температурт устай амархан урвалд ордог.
Жишээ 3... Натри, кали, кальци нь усанд амархан уусч шүлтийн уусмал үүсгэдэг.
2Na + 2H 2 O = 2NaOH + H 2
2K + 2H 2 O = 2KOH + H 2
Ca + 2H 2 O = Ca (OH) 2 + H 2
Устөрөгчөөс магни (хамааруулсан) хүртэлх хүчдэлийн хязгаарт байрлах металууд нь зарим тохиолдолд устай харилцан үйлчилдэг боловч урвал нь тодорхой нөхцлийг шаарддаг. Жишээлбэл, хөнгөн цагаан ба магни нь металлын гадаргуугаас оксидын хальсыг арилгасны дараа л H 2 O-тэй харилцан үйлчилж эхэлдэг. Төмөр нь өрөөний температурт устай урвалд ордоггүй, харин усны ууртай урвалд ордог. Кобальт, никель, цагаан тугалга, хар тугалга нь зөвхөн өрөөний температурт төдийгүй халах үед H 2 O-тэй бараг харьцдаггүй.
NER-ийн баруун талд байрлах металлууд (мөнгө, алт, цагаан алт) нь ямар ч нөхцөлд устай урвалд ордоггүй.
Металлуудын давсны усан уусмалтай харилцан үйлчлэл
Бид дараахь төрлийн хариу урвалын талаар ярих болно.
металл (*) + металлын давс (**) = металл (**) + металлын давс (*)
Энэ тохиолдолд одны тэмдэг нь исэлдэлтийн төлөв, металлын валентыг илэрхийлэхгүй, харин №1 металл ба 2-р металлыг ялгах боломжийг олгодог гэдгийг онцлон тэмдэглэхийг хүсч байна.
Ийм хариу үйлдэл хийхийн тулд гурван нөхцлийг нэгэн зэрэг хангасан байх ёстой.
- процесст оролцсон давс нь усанд ууссан байх ёстой (үүнийг уусах чадварын хүснэгтийг ашиглан шалгахад хялбар);
- металл (*) нь металлын зүүн талд (**) хүчдэлийн цуваа байх ёстой;
- металл (*) устай урвалд орох ёсгүй (үүнийг мөн EER-ээр амархан шалгадаг).
Жишээ 4... Хэд хэдэн хариу үйлдлийг авч үзье:
Zn + CuSO 4 = ZnSO 4 + Cu
K + Ni (NO 3) 2 ≠
Эхний урвалыг хийхэд хялбар, дээр дурдсан бүх нөхцөл хангагдсан: зэсийн сульфат нь усанд уусдаг, цайр нь зэсийн зүүн талд NER-д байдаг, Zn нь устай урвалд ордоггүй.
Эхний нөхцөл хангагдаагүй (зэс (II) сульфид нь усанд бараг уусдаггүй) тул хоёр дахь урвал нь боломжгүй юм. Гурав дахь урвал нь биелэх боломжгүй, учир нь хар тугалга нь төмрөөс бага идэвхтэй металл (NER-ийн баруун талд байрладаг). Эцэст нь, дөрөв дэх процесс нь кали нь устай урвалд ордог тул никель хур тунадас үүсгэхгүй; үүссэн калийн гидроксид нь давсны уусмалтай урвалд орж болох боловч энэ нь огт өөр процесс юм.
Нитратуудын дулааны задрал
Нитратууд нь азотын хүчлийн давс гэдгийг танд сануулъя. Бүх нитратууд халах үед задардаг боловч задралын бүтээгдэхүүний найрлага өөр байж болно. Найрлага нь стрессийн цуваа дахь металлын байрлалаар тодорхойлогддог.
Магнийн зүүн талд байрлах NER-д байрлах металлын нитратууд халах үед холбогдох нитрит ба хүчилтөрөгчийг үүсгэдэг.
2KNO 3 = 2KNO 2 + O 2
Mg-ээс Cu хүртэлх хүчдэлийн мужид байрлах металлын нитратуудын дулааны задралын явцад металлын исэл, NO 2 ба хүчилтөрөгч үүсдэг.
2Cu (NO 3) 2 = 2CuO + 4NO 2 + O 2
Эцэст нь, хамгийн бага идэвхтэй металлын нитратуудын задралын явцад (зэсийн баруун талд NER-д байрладаг) металл, азотын давхар исэл, хүчилтөрөгч үүсдэг.
Химийн урвал дахь металууд нь үргэлж бууруулагч бодис юм. Металлын бууралтын идэвхжил нь түүний цахилгаан химийн цуврал хүчдэл дэх байр суурийг илэрхийлдэг.
Цуврал дээр үндэслэн дараахь дүгнэлтийг гаргаж болно.
1. Энэ эгнээний зүүн талд метал байх тусам бууруулагч бодис нь илүү хүчтэй байдаг.
2. Метал бүр нь уусмал дахь давснаас баруун талд байгаа металуудыг нүүлгэн шилжүүлэх чадвартай
2Fe + 3CuSO 4 → 3Cu + Fe 2 (SO 4) 3
3. Устөрөгчийн зүүн талд хүчдэлийн цувралд байрлах металлууд нь түүнийг хүчлээс нүүлгэн шилжүүлэх чадвартай.
Zn + 2HCl → ZnCl 2 + H 2
4. Аливаа усан уусмал дахь хамгийн хүчтэй бууруулагч бодис (шүлтлэг ба шүлтлэг шороо) болох металууд эхлээд устай урвалд ордог.
Цахилгаан химийн цуваагаар тодорхойлогддог металлын нөхөн сэргээх чадвар нь түүний үелэх систем дэх байрлалтай үргэлж тохирдоггүй, учир нь хүчдэлийн цувралд зөвхөн атомын радиус төдийгүй электроны энергийг харгалзан үздэг. отряд.
Альдегид, тэдгээрийн бүтэц, шинж чанар. Хорхойн болон цууны альдегидийг олж авах, ашиглах.
Альдегид нь органик нэгдлүүд бөгөөд тэдгээрийн молекул нь устөрөгч, нүүрсустөрөгчийн радикалыг нэгтгэсэн карбонил бүлэг юм.
Метанал (формик альдегид)
Физик шинж чанар
Метанал - хийн бодис, усан уусмал - формалин
Химийн шинж чанар
Альдегидийн урвалж нь Cu (OH) 2 юм
Өргөдөл
Метанал ба этанал нь хамгийн өргөн хэрэглэгддэг. Метаналыг фенолтой урвалд оруулснаар фенол формальдегидийн давирхайг үйлдвэрлэхэд их хэмжээний метанал ашигладаг. Энэ давирхай нь төрөл бүрийн хуванцар үйлдвэрлэхэд зайлшгүй шаардлагатай. Хуванцарыг фенол-формальдегидийн давирхайг янз бүрийн дүүргэгчтэй хослуулан фенол хуванцар гэж нэрлэдэг. Фенол формальдегидийн давирхайг ацетон эсвэл спиртэнд уусгаснаар янз бүрийн лак гаргаж авдаг. Метанал нь мочевин CO (NH 2) 2-тай харилцан үйлчлэлцэх үед карбидын давирхай, түүнээс аминопласт үүсдэг. Эдгээр хуванцар материалаас цахилгаан техникийн хэрэгцээнд зориулж бичил сүвэрхэг материалыг хийдэг.Метаналыг мөн зарим эмийн бодис, будагч бодис үйлдвэрлэхэд ашигладаг. Массын 40% метанал агуулсан усан уусмалыг өргөн хэрэглэдэг. Үүнийг формалин гэж нэрлэдэг. Түүний хэрэглээ нь уургийн нугалах шинж чанарт суурилдаг.
Хүлээн авч байна
Альдегидийг алкан ба спиртийг исэлдүүлэх замаар гаргаж авдаг. Этанал нь этилийн усжилт ба этилийн исэлдэлтээр үүсдэг.
Тасалбарын дугаар 12
Гурав дахь үеийн химийн элементүүдийн өндөр исэл. Үелэх систем дэх химийн элементүүдийн байрлалтай холбоотойгоор тэдгээрийн шинж чанарыг хэмжих зүй тогтол. Оксидын ердийн химийн шинж чанарууд: үндсэн, амфотер, хүчиллэг.
ОксидЭдгээр нь хоёр химийн элементээс бүрдэх нарийн төвөгтэй бодис бөгөөд тэдгээрийн нэг нь исэлдэлтийн төлөвтэй "-2" хүчилтөрөгч юм.
Гурав дахь үеийн оксидууд нь:
Na 2 O, MgO, Al 2 O 3, SiO 2, P 2 O 5, SO 3, Cl 2 O 7.
Элементүүдийн исэлдэлтийн төлөв нэмэгдэхийн хэрээр ислийн хүчиллэг шинж чанар нэмэгддэг.
Na 2 O, MgO - үндсэн исэл
Al 2 O 3 - амфотерийн исэл
SiO 2, P 2 O 5, SO 3, Cl 2 O 7 нь хүчиллэг исэл юм.
Үндсэн исэл нь хүчилтэй урвалд орж давс, ус үүсгэдэг.
MgO + 2CH 3 COOH → (CH 3 COO) 2 Hg + H 2 O
Шүлт ба шүлтлэг шороон металлын исэл нь устай урвалд орж шүлт үүсгэдэг.
Na 2 O + HOH → 2NaOH
Үндсэн оксид нь хүчиллэг исэлтэй урвалд орж давс үүсгэдэг.
Na 2 O + SO 2 → Na 2 SO 3
Хүчиллэг исэл нь шүлттэй урвалд орж давс, ус үүсгэдэг
2NaOH + SO 3 → Na 2 SO 4 + H 2 O
Устай урвалд орж хүчил үүсгэдэг
SO 3 + H 2 O → H 2 SO 4
Амфотерийн исэл нь хүчил ба шүлттэй урвалд ордог
Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O
Шүлттэй
Al 2 O 3 + 2NaOH → 2NaAlO 2 + H 2 O
Өөх тос, тэдгээрийн шинж чанар, найрлага. Байгалийн өөх тос, бие махбод дахь өөх тосыг хувиргах. Өөх тосыг техникийн аргаар боловсруулах бүтээгдэхүүн, синтетик угаалгын нунтаг ойлголт. SMS бохирдлоос байгаль хамгаалах.
Өөх тосГлицерол ба карбоксилын хүчлүүдийн эфир юм.
Өөх тосны ерөнхий томъёо:

Хатуу өөх тос нь ихэвчлэн өндөр ханасан карбоксилын хүчлүүдээр үүсдэг - стеарин C 17 H 35 COOH, пальмитик C 15 H 31 COOH болон бусад. Шингэн өөх тосыг голчлон хамгийн өндөр ханаагүй карбоксилын хүчлүүд - олеин үүсгэдэг C 17 H 33 COOH, ганцаардмал C 17 H 31 COOH
Өөх тос нь нүүрсустөрөгч, уургийн хамт амьтан, ургамлын организмын нэг хэсэг юм. Эдгээр нь хүн, амьтны хоол хүнсний чухал хэсэг юм. Өөх тосыг исэлдүүлэх үед биед энерги ялгардаг. Өөх тос нь хоол боловсруулах эрхтэнд ороход ферментийн нөлөөн дор глицерин болон холбогдох хүчилд гидролиз болдог.
Гидролизийн бүтээгдэхүүн нь гэдэсний хөндийгөөр шингэж, дараа нь өөх тос нийлэгждэг боловч аль хэдийн биеийн онцлог шинж чанартай байдаг. Өөх тосыг цусны урсгалаар биеийн бусад эрхтэн, эд эс рүү зөөвөрлөж, тэнд хуримтлагдаж эсвэл дахин гидролиз болж, нүүрстөрөгчийн дутуу исэл (IV) болон ус руу аажмаар исэлддэг.
Физик шинж чанар.
Амьтны гаралтай өөх тос нь ихэнх тохиолдолд хатуу байдаг ч шингэн (загасны тос) байдаг. Ургамлын гаралтай өөх тос нь ихэвчлэн шингэн бодис байдаг - тос; Мөн хатуу ургамлын гаралтай өөх тосыг мэддэг - кокосын тос.
Химийн шинж чанар.
Амьтны организм дахь өөх тос нь ферментийн оролцоотойгоор гидролиз болдог. Устай урвалд орохоос гадна өөх тос нь шүлттэй харилцан үйлчилдэг.
Ургамлын тос нь ханаагүй карбоксилын хүчлүүдийн эфирийг агуулдаг тул устөрөгчжүүлж болно. Тэд эцсийн нэгдэл болж хувирдаг
Жишээ нь: Маргариныг үйлдвэрийн тосноос гаргаж авдаг.
Өргөдөл.
Өөх тосыг голчлон хүнсний бүтээгдэхүүн болгон ашигладаг. Өмнө нь өөх тосыг саван хийхэд ашигладаг байсан
Синтетик угаалгын нунтаг.
Синтетик угаалгын нунтаг нь байгаль орчинд хортой нөлөө үзүүлдэг. тэдгээр нь тэсвэрлэх чадвартай бөгөөд эвдэхэд хэцүү байдаг.
Гросс Э., Вайсмантел Х.
Сонирхогчдод зориулсан хими. Химийн үндэс ба хөгжилтэй туршлага.
3-р бүлэг (үргэлжлэл)МЕТАЛЛЫН ЦАХИЛГААН ХИМИЙН БАГА СУРГАЛТ
Бид аль хэдийн шүлтлэг металлын хлоридын уусмалын электролиз, хайлмал ашиглан металл үйлдвэрлэхтэй танилцсан. Одоо бид усан уусмал, гальваник эсийн цахилгаан химийн зохицуулалтын зарим хуулиудыг судлах, мөн хэд хэдэн энгийн туршилтуудыг ашиглан хамгаалалтын гальваник бүрээс үйлдвэрлэхтэй танилцахыг хичээх болно.Электрохимийн аргыг орчин үеийн аналитик химид онолын химийн хамгийн чухал утгыг тодорхойлоход ашигладаг.
Эцэст нь хэлэхэд, үндэсний эдийн засагт ихээхэн хохирол учруулдаг металл объектуудын зэврэлт нь ихэнх тохиолдолд цахилгаан химийн процесс юм.
МЕТАЛЛЫН ХҮЧЧДЛИЙН ХҮЧДЭЛ
Цахилгаан химийн процессыг ойлгох үндсэн холбоос бол металл дахь хүчдэлийн цуваа юм. Металлуудыг дараалан байрлуулж болох бөгөөд энэ нь химийн идэвхжилээс эхэлж, хамгийн бага идэвхтэй үнэт металлаар төгсдөг.Li, Rb, K, Ba, Sr, Ca, Mg, Al, Be, Mn, Zn, Cr, Ga, Fe, Cd, Tl, Co, Ni, Sn, Pb, H, Sb, Bi, As, Cu, Hg, Ag, Pd, Pt, Au.
Энэ нь хамгийн сүүлийн үеийн үзэл баримтлалын дагуу хамгийн чухал металл, устөрөгчийн хувьд хэд хэдэн стресс юм шиг харагдаж байна. Хэрэв гальван элементийн электродууд нь дараалсан хоёр металлаар хийгдсэн бол эгнээний өмнөх материал дээр сөрөг хүчдэл гарч ирнэ.
Хүчдэлийн утга ( цахилгаан химийн потенциал) хүчдэлийн цуваа дахь элементийн байрлал ба электролитийн шинж чанараас хамаарна.
Хүчдэлийн цувралын мөн чанарыг хэд хэдэн энгийн туршилтаар олж мэдье, үүнд одоогийн эх үүсвэр, цахилгаан хэмжих хэрэгсэл хэрэгтэй болно. 10 г талст зэсийн сульфатыг 100 мл усанд уусгаж, уусмалд ган зүү эсвэл төмөр цагаан тугалга дүрнэ. (Бид эхлээд төмрийг гялалзтал нарийн зүлгүүрээр цэвэрлэхийг зөвлөж байна.) Богино хугацааны дараа төмрийг улаавтар тунадасжуулсан зэс давхаргаар бүрхэнэ. Илүү идэвхтэй төмөр нь уусмалаас зэсийг нүүлгэн шилжүүлж, төмөр нь ион хэлбэрээр уусч, зэс нь метал хэлбэрээр ялгардаг. Уусмалыг төмрөөр шүргэлцэх хүртэл процесс үргэлжилнэ. Зэс нь төмрийн гадаргууг бүхэлд нь бүрхмэгц энэ нь бараг зогсох болно. Энэ тохиолдолд нэлээд сүвэрхэг зэс давхарга үүсдэг тул гүйдэл ашиглахгүйгээр хамгаалалтын бүрээсийг авах боломжгүй юм.
Дараах туршилтуудад цайр, тугалган цагаан тугалганы жижиг туузыг зэсийн сульфатын уусмалд дүрж үзье. 15 минутын дараа тэдгээрийг гаргаж аваад зайлж, микроскопоор шалгана. Бид ойсон гэрэлд улаан өнгөтэй, ялгарсан зэсээс бүрдсэн мөс шиг үзэсгэлэнтэй хэв маягийг ялгах болно. Энд мөн илүү идэвхтэй металлууд зэсийг ионоос металл төлөвт шилжүүлсэн.
Зэс нь эргээд хүчдэлийн цуваанаас доогуур, өөрөөр хэлбэл идэвхгүй металуудыг нүүлгэж чаддаг. Нимгэн туузан зэс хуудас эсвэл хавтгай зэс утсан дээр мөнгөн нитратын уусмалыг хэдэн дусал дуслаарай (өмнө нь гадаргууг гялалзуулж будсан). Энгийн нүдээр харахад микроскопоор туссан гэрлийн дор нимгэн зүү, ургамлын хэв маяг (дендрит гэж нэрлэгддэг) шиг харагддаг хар өнгийн товруу харагдах болно.
Цайрыг гүйдэлгүйгээр тусгаарлахын тулд илүү идэвхтэй металл ашиглах шаардлагатай. Устай хүчтэй харилцан үйлчилдэг металлыг эс тооцвол цайрын дээрх хүчдэлийн цувралд магни олддог. Цайрын сульфатын уусмалыг хэдэн дусал магнийн соронзон хальс эсвэл электрон нимгэн чип дээр хийнэ. Бид цайрын нэг хэсгийг шингэрүүлсэн хүхрийн хүчилд уусган цайрын сульфатын уусмалыг олж авдаг. Цайрын сульфаттай хамт хэдэн дусал денатурат спирт нэмнэ. Магнийн хувьд богино хугацааны дараа бид ялангуяа микроскопоор цайр нимгэн талст хэлбэрээр тунадасжиж байгааг анзаардаг.
Ерөнхийдөө хүчдэлийн цувралын аль ч гишүүнийг уусмалаас нүүлгэн шилжүүлж, ион хэлбэрээр байрлуулж, металл төлөвт хувиргаж болно. Гэсэн хэдий ч, бид бүх төрлийн хослолыг туршиж үзэхэд бид урам хугарах болно. Хэрэв хөнгөн цагаан туузыг зэс, төмөр, хар тугалга, цайрын давсны уусмалд дүрвэл эдгээр металлыг түүн дээр гаргах хэрэгтэй юм шиг санагддаг. Гэхдээ энэ нь тохиолдохгүй байна. Алдаа дутагдлын шалтгаан нь цуврал стрессийн алдаа биш, харин урвалын тусгай дарангуйлал дээр суурилдаг бөгөөд энэ тохиолдолд хөнгөн цагаан гадаргуу дээр нимгэн ислийн хальс үүссэнтэй холбоотой юм. Ийм шийдэлд хөнгөн цагааныг идэвхгүй гэж нэрлэдэг.
ХИЧЭЭЛИЙН ЦААС ХАРАЦГААЯ
Үргэлжилж буй үйл явцын зүй тогтлыг томъёолохын тулд бид катионуудыг авч үзэх замаар өөрсдийгөө хязгаарлаж, анионууд өөрсдөө урвалд оролцдоггүй тул тэдгээрийг хасч болно. (Үнэн, анионуудын төрөл нь тунадасжилтын хурдад нөлөөлдөг.) Хэрэв тунадасжсан болон ууссан металл хоёулаа давхар цэнэгтэй катионуудыг өгдөг гэж үзвэл бид дараахь зүйлийг бичиж болно.Би 1 + Би 2 2+ = Би 1 2+ + Би 2
Түүнээс гадна эхний туршилтын хувьд Me 1 = Fe, Me 2 = Cu байна.
Тиймээс процесс нь хоёр металлын атом ба ионуудын хооронд цэнэг (электрон) солилцохоос бүрдэнэ. Хэрэв бид төмрийн уусах эсвэл зэсийн тунадасжилтыг тусад нь (завсрын урвал гэж) авч үзвэл бид дараахь зүйлийг авна.
Fe = Fe 2+ + 2 д --
Cu 2+ + 2 д- = Су
Одоо металыг ус эсвэл давсны уусмалд дүрж, хүчдэлийн цуваа дахь байрлалаас шалтгаалан катион нь солилцох боломжгүй болсон тохиолдлыг авч үзье. Гэсэн хэдий ч метал нь ион хэлбэрээр уусмал руу орох хандлагатай байдаг. Энэ тохиолдолд металлын атом нь хоёр электроноос татгалзаж (хэрэв метал нь хоёр валенттай бол), уусмалд дүрсэн металлын гадаргуу нь уусмалаас сөрөг цэнэгтэй болж, интерфэйс дээр давхар цахилгаан давхарга үүсдэг. Энэ боломжит ялгаа нь металыг цаашид уусгахаас сэргийлж, процесс удахгүй зогсох болно.
Хэрэв хоёр өөр металлыг уусмалд дүрвэл хоёулаа цэнэглэгддэг боловч идэвхгүй нь бага зэрэг сул байдаг, учир нь атомууд нь электронуудыг салгахад бага өртөмтгий байдаг.
Хоёр металлыг дамжуулагчаар холбоно. Боломжит ялгааны улмаас электронуудын урсгал нь элементийн эерэг туйлыг бүрдүүлдэг илүү идэвхтэй металаас идэвхгүй бага руу урсах болно. Уусмал руу илүү идэвхтэй металл орж, илүү эрхэм металл дээр уусмалаас катионууд ялгардаг процесс байдаг. Одоо дээр дурдсан хийсвэр үндэслэлийг хэд хэдэн туршилтаар дүрслэн харуулъя (үүнээс гадна энэ нь бүдүүлэг хялбаршуулсан байдлыг илэрхийлдэг).
Эхлээд 250 мл-ийн аяганд 10% хүхрийн хүчлийн уусмалаар дүүргэж, цайр, зэсийн жижиг хэсгүүдийг дүрнэ. Бид хоёр электрод руу зэс утсыг гагнах юм уу тав, төгсгөл нь уусмалд хүрэх ёсгүй.
Утасны төгсгөлүүд хоорондоо холбогдоогүй л бол бид цайрын уусалтыг ажиглах бөгөөд энэ нь устөрөгчийн ялгаралт дагалддаг. Хүчдэлийн цувралаас үзэхэд цайр нь устөрөгчөөс илүү идэвхтэй байдаг тул метал нь устөрөгчийг ионы төлөв байдлаас нь зайлуулж чаддаг. Хоёр металл дээр цахилгаан давхар давхарга үүсдэг. Электродуудын хоорондох боломжит зөрүүг вольтметрээр илрүүлэхэд хамгийн хялбар байдаг. Төхөөрөмжийг хэлхээнд холбосны дараа сум нь ойролцоогоор 1 В-ийг зааж өгөх боловч дараа нь хүчдэл хурдан буурах болно. Хэрэв та элементэд 1 В хүчдэл хэрэглэдэг жижиг гэрлийн чийдэнг холбовол энэ нь эхлээд нэлээд хүчтэй асна, дараа нь гэрэл нь сул болно.
Төхөөрөмжийн терминалуудын туйлшралын дагуу зэс электрод нь эерэг туйл гэж дүгнэж болно. Процессын цахилгаан химийн талаар авч үзэх замаар үүнийг төхөөрөмжгүйгээр баталж болно. Жижиг аяганд эсвэл туршилтын хоолойд энгийн давсны ханасан уусмал бэлтгэж, 0.5 мл орчим фенолфталеины индикаторын спиртийн уусмал нэмж, хоёр электродыг утсаар битүүмжилсэн уусмал руу дүрнэ. Сөрөг туйлын ойролцоо бага зэрэг улаавтар өнгө ажиглагдах бөгөөд энэ нь катод дахь натрийн гидроксид үүссэнээс үүсдэг.
Бусад туршилтуудад төрөл бүрийн металлын уурыг үүрэнд байрлуулж, үүссэн хүчдэлийг тодорхойлж болно. Жишээлбэл, магни, мөнгө нь хэд хэдэн хүчдэлийн хоорондох зайнаас ихээхэн хэмжээний боломжит зөрүүг өгдөг бөгөөд цайр, төмөр нь эсрэгээрээ маш бага, вольтын аравны нэгээс бага байдаг. Хөнгөн цагааны тусламжтайгаар бид идэвхгүй байдлын улмаас бараг ямар ч гүйдэл хүлээн авахгүй.
Эдгээр бүх элементүүд буюу цахилгаан химичүүдийн хэлснээр хэлхээнүүд нь гүйдэл авах үед хүчдэл маш хурдан унадаг сул талтай. Тиймээс цахилгаан химичүүд хүчдэлийн нөхөн олговрын аргыг ашиглан, өөрөөр хэлбэл өөр гүйдлийн эх үүсвэрийн хүчдэлтэй харьцуулах замаар хүчдэлгүй байдалд байгаа хүчдэлийн жинхэнэ утгыг үргэлж хэмждэг.
Зэс-цайрын элемент дэх үйл явцыг илүү нарийвчлан авч үзье. Катод дээр цайр дараах тэгшитгэлийн дагуу уусмалд ордог.
Zn = Zn 2+ + 2 д --
Зэсийн анод дээр хүхрийн хүчлийн устөрөгчийн ионууд ялгардаг. Тэд цайрын катодын утсан дээр ирж буй электронуудыг холбож, улмаар устөрөгчийн бөмбөлөгүүд үүсдэг.
2H + + 2 д- = H 2
Богино хугацааны дараа зэс нь устөрөгчийн бөмбөлгүүдийн хамгийн нимгэн давхаргаар бүрхэгдсэн байх болно. Энэ тохиолдолд зэс электрод нь устөрөгч болж хувирах ба боломжит ялгаа буурах болно. Энэ процессыг электродын туйлшрал гэж нэрлэдэг. Хүчдэл буурсаны дараа эсэд бага зэрэг калийн бихромат уусмал нэмснээр зэс электродын туйлшралыг арилгаж болно. Үүний дараа калийн бихромат нь устөрөгчийг исэлдүүлэх тул хүчдэл дахин нэмэгдэх болно. Энэ тохиолдолд калийн бихромат нь деполяризаторын үүрэг гүйцэтгэдэг.
Практикт электродууд нь туйлшираагүй гальваник хэлхээ, эсвэл деполяризатор нэмэх замаар туйлшралыг арилгах боломжтой хэлхээг ашигладаг.
Туйлшрахгүй элементийн жишээ болгон урьд өмнө нь одоогийн эх сурвалж болгон ашигладаг Даниел элементийг авч үзье. Энэ нь бас зэс-цайрын элемент боловч хоёр металл хоёулаа өөр өөр уусмалд дүрэгдсэн байдаг. Цайрын электродыг шингэрүүлсэн (ойролцоогоор 20%) хүхрийн хүчлээр дүүргэсэн сүвэрхэг шаварлаг үүрэнд хийнэ. Шаварлаг эсийг зэсийн сульфатын төвлөрсөн уусмал агуулсан том шилэнд түдгэлзүүлсэн бөгөөд доод хэсэгт нь зэсийн сульфатын талст давхарга байдаг. Энэ савны хоёр дахь электрод нь зэс хуудас цилиндр юм.
Энэ элементийг шилэн сав, худалдаанд гарах шавар эс (чимхлээр бид цэцгийн сав хэрэглэдэг, ёроолын нүхийг хамардаг) болон тохирох хэмжээтэй хоёр электродоос хийж болно.
Эсийн үйл ажиллагааны явцад цайр уусч цайрын сульфат үүсгэх ба зэсийн электрод дээр зэсийн ионууд ялгардаг. Гэхдээ үүнтэй зэрэгцэн зэс электрод нь туйлшрахгүй бөгөөд элемент нь ойролцоогоор 1 В хүчдэл өгдөг. Үнэндээ онолын хувьд терминал дээрх хүчдэл нь 1.10 В, гэхдээ бид гүйдлийг арилгахад бид арай бага утгыг хэмждэг. , эсийн цахилгаан эсэргүүцлийн улмаас.
Хэрэв бид эсээс гүйдлийг арилгахгүй бол хүхрийн хүчлийн уусмалаас цайрын электродыг зайлуулах хэрэгтэй, эс тэгвээс устөрөгч үүсгэхийн тулд уусна.
Сүвэрхэг хаалт шаарддаггүй энгийн эсийн диаграммыг зурагт үзүүлэв. Цайрын электрод нь шилэн саванд дээд талд, зэс электрод нь доод талд байрладаг. Бүхэл эс нь ханасан натрийн хлоридын уусмалаар дүүрсэн байна. Савны ёроолд бид зэсийн сульфатын цөөн тооны талстыг асгах болно. Үүссэн төвлөрсөн зэсийн сульфатын уусмал нь натрийн хлоридын уусмалтай маш удаан холилдоно. Тиймээс эс ажиллаж байх үед зэс электрод дээр зэс ялгарах ба сульфат эсвэл хлорид хэлбэрийн цайр нь эсийн дээд хэсэгт уусдаг.
Өнөө үед хуурай эсийг бараг зөвхөн батерейнд ашигладаг бөгөөд энэ нь ашиглахад илүү тохиромжтой. Тэдний өвөг дээдэс нь Лекланш элемент юм. Цайрын цилиндр ба нүүрстөрөгчийн савааг электрод болгон ашигладаг. Электролит нь гол төлөв аммонийн хлоридоос бүрддэг зуурмаг юм. Зуурмагт цайр уусч, нүүрсэнд устөрөгч ялгардаг. Туйлшралаас зайлсхийхийн тулд нүүрстөрөгчийн саваа нь нүүрсний нунтаг ба пиролизитын холимог агуулсан маалинган уутанд дүрнэ. Нүүрстөрөгчийн нунтаг нь электродын гадаргууг ихэсгэдэг бол пиролизит нь устөрөгчийг аажмаар исэлдүүлдэг деполяризаторын үүрэг гүйцэтгэдэг.
Пиролюзитын деполяризаци хийх чадвар нь өмнө дурдсан калийн бихроматаас сул байдаг. Тиймээс хуурай эсүүдэд гүйдэл хүлээн авах үед хүчдэл хурдан буурч, тэд " ядрах"туйлшралын улмаас. Хэсэг хугацааны дараа л устөрөгчийн пиролюзит исэлдэлт үүсдэг. Тиймээс элементүүд" амралтаа авах"Хэрэв бид хэсэг хугацаанд гүйдэл дамжуулахгүй бол. Үүнийг гар чийдэнгийн батерей дээр шалгаж үзье, бид чийдэнг холбодог. Дэнлүүтэй зэрэгцээ, өөрөөр хэлбэл шууд терминалуудтай бид вольтметрийг холбодог.
Эхний үед хүчдэл нь ойролцоогоор 4.5 В байх болно. (Ихэнхдээ ийм батерейнд гурван эсийг цувралаар холбодог бөгөөд тус бүр нь 1.48 В-ийн онолын хүчдэлтэй байдаг.) Хэсэг хугацааны дараа хүчдэл буурч, чийдэнгийн гэрэлтэх болно. сулрах. Вольтметрийн уншилтын дагуу бид батерейг хэр удаан амрах шаардлагатайг шүүх боломжтой болно.
гэж нэрлэгддэг нөхөн төлжих элементүүд онцгой байр эзэлдэг аккумляторууд... Тэдгээрийн дотор урвуу урвал явагддаг бөгөөд гаднах тогтмол гүйдлийн эх үүсвэрт холбогдон эсийг цэнэггүй болгосны дараа дахин цэнэглэгддэг.
Хар тугалганы хүчлийн батерейнууд одоогоор хамгийн түгээмэл байдаг; Тэдгээрийн дотор шингэрүүлсэн хүхрийн хүчил нь электролитийн үүрэг гүйцэтгэдэг бөгөөд үүнд хоёр хар тугалганы хавтанг дүрдэг. Эерэг электрод нь хар тугалганы давхар исэл PbO 2, сөрөг нь металл хар тугалга юм. Терминалуудын хүчдэл нь ойролцоогоор 2.1 В байна. Цэнэглэх үед хоёр хавтан дээр хар тугалганы сульфат үүсдэг бөгөөд энэ нь цэнэглэгдсэн үед дахин металл хар тугалга болон хар тугалганы хэт исэл болж хувирдаг.
ЦАЙРСАН БҮРЭЭГИЙН ХЭРЭГЛЭЭ
Цахилгаан гүйдэл ашиглан усан уусмалаас металл хуримтлуулах нь гальваник эсийг авч үзэх үед тааралдсан электролитийн уусалтын урвуу үйл явц юм. Юуны өмнө бид зэсийн колометрт цахилгааны хэмжээг хэмжихэд ашигладаг зэсийн хуримтлалыг судалж байна.Металл нь гүйдлээр хуримтлагддаг
Хоёр нимгэн зэс хавтангийн үзүүрийг сугалж, шилэн аяга эсвэл жижиг шилэн аквариумын эсрэг талд өлгө. Бид утсыг терминалуудтай хавтангаар холбодог.
ЭлектролитДараах жорын дагуу бэлтгэ: 125 г талст зэсийн сульфат, 50 г төвлөрсөн хүхрийн хүчил, 50 г спирт (денатурат спирт), үлдсэн хэсэг нь 1 литр хүртэл ус юм. Үүнийг хийхийн тулд эхлээд зэсийн сульфатыг 500 мл усанд уусгаж, дараа нь жижиг хэсгүүдэд хүхрийн хүчил нэмнэ ( Халаалт! Шингэн асгарч магадгүй!), дараа нь архи асгаж, 1 литр эзэлхүүнтэй ус авчирна.
Кулометрийг бэлтгэсэн уусмалаар дүүргэж, хувьсах эсэргүүцэл, амперметр, хар тугалганы зайг хэлхээнд холбоно. Эсэргүүцлийг ашиглан бид гүйдлийг тохируулж, түүний нягт нь электродын гадаргуугийн 0.02-0.01 А / см 2 байна. Хэрэв зэс хавтан нь 50 см 2 талбайтай бол одоогийн хүч нь 0.5-1 А байх ёстой.
Хэсэг хугацааны дараа цайвар улаан металл зэс нь катод (сөрөг электрод) дээр тунадасжиж эхлэх бөгөөд зэс нь анод (эерэг электрод) уусмалд орно. Зэсийн хавтанг цэвэрлэхийн тулд бид хагас цагийн турш гүйдлийг кулометрээр дамжуулна. Дараа нь бид катодыг гаргаж аваад шүүлтүүрийн цаасаар сайтар хатааж, нарийн жинлэнэ. Электродыг үүрэнд суурилуулж, хэлхээг реостатаар хааж, тогтмол гүйдлийн хүчийг, жишээлбэл 1 А. Нэг цагийн дараа хэлхээг нээж, хатаасан катодыг дахин жинлэнэ. Ажиллаж байгаа цагт 1 А гүйдлийн үед түүний масс 1.18 г-аар нэмэгдэнэ.
Тиймээс 1 ампер-цагтай тэнцэх хэмжээний цахилгаан нь уусмалаар дамжин өнгөрөхөд 1.18 г зэс ялгаруулж болно. Эсвэл ерөнхийдөө: бодисын ялгарах хэмжээ нь уусмалаар дамжин өнгөрөх цахилгааны хэмжээтэй шууд пропорциональ байна.
1 эквивалент ионыг тусгаарлахын тулд электродын цэнэгийн e ба Авогадрогийн тооны үржвэртэй тэнцэх хэмжээний цахилгааныг уусмалаар нэвтрүүлэх шаардлагатай. НХ:
e * n A = 1.6021 * 10 -19 * 6.0225 * 10 23 = 9.65 * 10 4 A * s * моль -1 Энэ утгыг тэмдэгтээр илэрхийлнэ. Фэлектролизийн тоон хуулиудыг нээсний нэрээр нэрлэгдсэн Фарадей дугаар(яг үнэ цэнэ Ф- 96 498 A * с * моль -1). Тиймээс уусмалаас өгөгдсөн тооны эквивалентыг тусгаарлах n e уусмалаар дамжуулан цахилгааны хэмжээ тэнцүү байна F * n e A * s * моль -1. Өөрөөр хэлбэл,
би * т =F * nӨө энд I- Одоогийн, т- уусмалаар гүйдэл дамжих хугацаа. "Бүлэгт" Титрлэлтийн үндэс"Бодисын эквивалентийн тоо аль хэдийн нотлогдсон n e нь молийн тооны үржвэртэй тэнцүү тоогоор тэнцүү байна:
n e = n*ЗТиймээс:
I*т = F * n * Z
Энэ тохиолдолд З- ионы цэнэг (Ag + хувьд З= 1, Cu 2+ хувьд З= 2, Al 3+-ийн хувьд З= 3 гэх мэт). Хэрэв бид молийн тоог масс ба молийн массын харьцаагаар илэрхийлбэл ( n = м / М), дараа нь бид электролизийн явцад тохиолддог бүх процессыг тооцоолох боломжийг олгодог томъёог авна.
би * т =F * м * Z / М
Энэ томъёог ашиглан та гүйдлийг тооцоолж болно:
I = F * м * Z / (t * М)= 9.65 * 10 4 * 1.18 * 2 / (3600 * 63.54) A * с * г * моль / (с * моль * г) = 0.996 А
Хэрэв бид цахилгааны ажлын харьцааг танилцуулбал Вцахим шуудан
Вимэйл = U * I * tболон В e / У = би * т
Хурцадмал байдлыг мэддэг У, та тооцоолж болно:
Вимэйл = F * м * Z * U / М
Мөн та тодорхой хэмжээний бодисыг электролитийн аргаар гаргахад хэр хугацаа шаардагдахыг эсвэл тодорхой хугацаанд хичнээн хэмжээний бодис ялгардагийг тооцоолж болно. Туршилтын явцад гүйдлийн нягтыг тогтоосон хязгаарт байлгах ёстой. Хэрэв энэ нь 0.01 А / см 2-ээс бага бол зэс (I) ионууд хэсэгчлэн үүсэх тул хэт бага металл ялгарах болно. Хэрэв гүйдлийн нягтрал хэт өндөр байвал бүрээсийн наалдац нь электрод сул байх бөгөөд электродыг уусмалаас салгахад энэ нь сүйрч болно.
Практикт металлаар бүрсэн цахилгаан бүрээсийг голчлон зэврэлтээс хамгаалах, толин тусгал өнгөлгөө авахад ашигладаг.
Үүнээс гадна метал, ялангуяа зэс, хар тугалга нь анод уусгах, дараа нь катод (электролитийн цэвэршүүлэх) дээр ялгах замаар цэвэршдэг.
Төмрийг зэс эсвэл никельээр бүрэхийн тулд эхлээд тухайн зүйлийн гадаргууг сайтар цэвэрлэх хэрэгтэй. Үүнийг хийхийн тулд цайруулсан шохойгоор өнгөлж, дараа нь натрийн гидроксидын шингэрүүлсэн уусмал, ус, спиртээр тосоор арилгана. Хэрэв эд зүйл зэвэнд хучигдсан бол түүнийг 10-15% хүхрийн хүчлийн уусмалд урьдчилан сийлсэн байх ёстой.
Бид цэвэрлэсэн бүтээгдэхүүнийг электролитийн ваннд (жижиг аквариум эсвэл аяга) өлгөж, катодын үүрэг гүйцэтгэдэг.
Зэс бүрэх уусмал нь 1 литр усанд 250 г зэсийн сульфат, 80-100 г төвлөрсөн хүхрийн хүчил агуулдаг (Анхаарал!). Энэ тохиолдолд зэс хавтан нь анодын үүрэг гүйцэтгэнэ. Анодын гадаргуу нь бүрэх объектын гадаргуутай ойролцоогоор тэнцүү байх ёстой. Тиймээс, зэсийн анод нь катодтой ижил гүнд ваннд өлгөгдсөн байх ёстой.
Уг процессыг 3-4 В (хоёр батерей) хүчдэл, 0.02-0.4 А / см 2 гүйдлийн нягтаар гүйцэтгэнэ. Усанд орох уусмалын температур 18-25 ° C байх ёстой.
Анодын хавтгай ба бүрэх гадаргуу нь хоорондоо параллель байгааг анхаарч үзээрэй. Нарийн төвөгтэй хэлбэрийн объектыг ашиглахгүй байх нь дээр. Электролизийн үргэлжлэх хугацааг өөрчилснөөр янз бүрийн зузаантай зэс бүрэх боломжтой.
Энэ давхаргад өөр металлын бат бөх бүрээсийг хэрэглэхийн тулд зэсийн өмнөх бүрээсийг ихэвчлэн ашигладаг. Энэ нь ялангуяа төмрийг хром бүрэх, цайрын цутгамал никель бүрэх болон бусад тохиолдолд ихэвчлэн ашиглагддаг. Энэ зорилгоор маш хортой цианидын электролитийг ашигладаг нь үнэн.
Никель бүрэх электролит бэлтгэхийн тулд бид 25 г талст никель сульфат, 10 г борын хүчил эсвэл 10 г натрийн цитратыг 450 мл усанд уусгана. Натрийн цитратыг 10 г нимбэгийн хүчлийн уусмалыг натрийн гидроксидын шингэрүүлсэн уусмал эсвэл содын уусмалаар саармагжуулах замаар өөрөө бэлтгэж болно. Анод нь хамгийн том талбайн никель хавтан байх ба батерейг хүчдэлийн эх үүсвэр болгон ав.
Хувьсах эсэргүүцлийг ашиглан одоогийн нягтын утгыг 0.005 А / см 2-тай тэнцүү байлгах болно. Жишээлбэл, объектын гадаргуу нь 20 см 2 бол 0.1 А-ийн гүйдлийн хүчээр ажиллах шаардлагатай. Хагас цаг ажилласны дараа объект аль хэдийн никель бүрсэн байх болно. Үүнийг ваннаас гаргаж аваад даавуугаар арчъя. Гэсэн хэдий ч никель бүрэх процессыг тасалдуулахгүй байх нь дээр, учир нь никель давхаргыг идэвхгүй болгож, дараагийн никель бүрэх нь сайн наалддаггүй.
Механик өнгөлгөөгүйгээр толин тусгал мэт гялалзахын тулд бид гялбаа үүсгэгч нэмэлт бодисыг цахилгаан бүрээстэй ваннд оруулдаг. Ийм нэмэлтүүд нь жишээлбэл, цавуу, желатин, элсэн чихэр юм. Жишээлбэл, та никель ваннд хэдэн грамм элсэн чихэр хийж, түүний үр нөлөөг судалж болно.
Төмрийг хромоор бүрэх электролит бэлтгэхийн тулд (урьдчилсан зэсээр бүрсэний дараа) 100 мл усанд 40 г хромын хүчлийн ангидрид CrO 3 (Анхаарал! Хор!), яг 0.5 г хүхрийн хүчил (ямар ч илүү тохиолдолд) уусгана! ). Уг процесс нь ойролцоогоор 0.1 А / см 2 гүйдлийн нягттай үед явагддаг бөгөөд хар тугалганы хавтанг анод болгон ашигладаг бөгөөд түүний талбай нь хром бүрсэн гадаргуугийн талбайгаас арай бага байх ёстой.
Никель ба хром банн нь бага зэрэг халаадаг (ойролцоогоор 35 ° C хүртэл). Хром бүрэх зориулалттай электролитууд, ялангуяа урт процесс, өндөр гүйдлийн хүч нь хромын хүчил агуулсан уур ялгаруулдаг бөгөөд энэ нь эрүүл мэндэд маш их хор хөнөөл учруулдаг. Тиймээс хром бүрэх ажлыг зүтгүүрийн дор эсвэл гадаа, жишээлбэл тагтан дээр хийх ёстой.
Хромоор бүрэх (ба бага хэмжээгээр никель бүрэх) үед бүх гүйдлийг металлын хуримтлалд ашигладаггүй. Үүний зэрэгцээ устөрөгч үүсдэг. Хэд хэдэн стрессийн үндсэн дээр устөрөгчтэй тулгардаг металлууд усан уусмалаас огт чөлөөлөгдөх ёсгүй, харин эсрэгээр бага идэвхтэй устөрөгч ялгарах ёстой. Гэсэн хэдий ч энд металлын анод уусалтын нэгэн адил катодын устөрөгчийн хувьсал ихэвчлэн саатдаг бөгөөд зөвхөн өндөр хүчдэлд ажиглагддаг. Энэ үзэгдлийг устөрөгчийн хэт хүчдэл гэж нэрлэдэг бөгөөд энэ нь ялангуяа хар тугалга дээр, жишээлбэл, маш сайн байдаг. Энэ нөхцөл байдлаас шалтгаалан хар тугалга батерей ажиллах боломжтой. Батерейг цэнэглэх үед PbO 2-ийн оронд устөрөгч катод дээр гарч ирэх ёстой боловч хэт хүчдэлийн улмаас батерейг бүрэн цэнэглэх үед устөрөгчийн хувьсал эхэлдэг.
"Электродын бодис - уусмал" боломжит ялгаа нь бодисын чадварын тоон шинж чанар болдог (металл баметалл бус) нь ион хэлбэрээр уусмалд ордог, i.e. шинж чанарион ба түүнд харгалзах бодисын OB чадварын саваа.
Үүнийг боломжит ялгаа гэж нэрлэдэгэлектродын потенциал.
Гэсэн хэдий ч ийм боломжит зөрүүг хэмжих шууд аргуудбайхгүй тул бид тэдгээрийг хамааруулан тодорхойлохоор тохиролцсонстандарт устөрөгчийн электрод гэж нэрлэгддэг потенциалal-ыг уламжлалт байдлаар тэг гэж авдаг (ихэвчлэн бас гэж нэрлэдэглавлагаа электрод). Стандарт устөрөгчийн электрод нь дараахь зүйлээс бүрдэнэконтой хүчлийн уусмалд дүрсэн цагаан алтны хавтангаасН + ионуудын төвлөрөл 1 моль / л ба хийн урсгалаар угаанастандарт нөхцөлд устөрөгч.
Стандарт устөрөгчийн электрод дээр потенциал үүсэхийг дараах байдлаар төсөөлж болно. Хийн устөрөгч нь цагаан алтаар шингэж атомын төлөвт шилждэг.
H 2 2H.
Динамик тэнцвэрийн төлөв нь хавтангийн гадаргуу дээр үүссэн атомын устөрөгч, уусмал дахь устөрөгчийн ион ба цагаан алт (электрон!) хооронд явагдана.
H H + + e.
Ерөнхий үйл явцыг тэгшитгэлээр илэрхийлнэ.
H 2 2H + + 2e.
Платинум нь исэлдэлтийн процесст оролцдоггүйболон үйл явц, гэхдээ зөвхөн атомын устөрөгчийн тээвэрлэгч юм.
Хэрэв 1 моль / л-тэй тэнцэх металлын ионы агууламжтай давсны уусмалд дүрсэн тодорхой металлын хавтанг стандарт устөрөгчийн электродтой холбосон бол гальваник эсийг олж авна. Энэ элементийн цахилгаан хөдөлгөгч хүч(EMF), 25 ° C хэмд хэмжигддэг бөгөөд металлын стандарт электродын потенциалыг тодорхойлдог бөгөөд ихэвчлэн E 0 гэж тэмдэглэдэг.
H 2 / 2H + системтэй холбоотойгоор зарим бодисууд исэлдүүлэгч бодис, бусад нь бууруулагч бодисоор ажиллах болно. Одоогийн байдлаар бараг бүх металл ба олон металл бус металлын стандарт потенциалыг олж авсан бөгөөд энэ нь бууруулагч бодис эсвэл исэлдүүлэгчийн электроныг буцааж өгөх эсвэл барьж авах харьцангуй чадварыг тодорхойлдог.
Устөрөгчийн хувьд бууруулагчийн үүрэг гүйцэтгэдэг электродын потенциал нь "-" тэмдэгтэй, "+" тэмдэг нь исэлдүүлэгч бодис болох электродын потенциалыг тэмдэглэнэ.
Хэрэв металууд нь стандарт электродын потенциалын өсөх дарааллаар байрласан бол энэ нь гэж нэрлэгддэг металлын хүчдэлийн цахилгаан химийн цуврал:
Li, Rb, K, Ba, Sr, Ca, N a, M g, A l, M n, Zn, C r, F e, C d, Co, N i, Sn, P b, H, Sb, B i, С u, Hg, А g, Р d, Р t, А u.
Хэд хэдэн стресс нь металлын химийн шинж чанарыг тодорхойлдог.
1. Металлын электродын потенциал сөрөг байх тусам түүний бууралт их болно.
2. Метал бүр нь давсны уусмалаас түүний дараа металлын хүчдэлийн цуваа дахь металуудыг нүүлгэн шилжүүлэх (багасгах) чадвартай. Цорын ганц үл хамаарах зүйл бол шүлтлэг ба шүлтлэг шороон металууд бөгөөд тэдгээр нь бусад металлын ионыг давсны уусмалаас бууруулдаггүй. Энэ нь эдгээр тохиолдолд металлын устай харилцан үйлчлэх урвал илүү өндөр хурдтай явагддагтай холбоотой юм.
3. Сөрөг стандарт электродын потенциалтай бүх металууд, өөрөөр хэлбэл E. Устөрөгчийн зүүн талд байгаа металлын хүчдэлийн цуваа нь түүнийг хүчиллэг уусмалаас нүүлгэн шилжүүлэх чадвартай.
Потенциалууд нь уусгагч молекулуудтай нэг буюу өөр ионы харилцан үйлчлэлийн онцлогийг харгалзан үздэг тул танилцуулсан цувралууд нь зөвхөн усан уусмал дахь метал ба тэдгээрийн давсны шинж чанарыг тодорхойлдог гэдгийг тэмдэглэх нь зүйтэй. Тийм ч учраас цахилгаан химийн цуврал нь литийээс эхэлдэг бол химийн идэвхтэй рубиди ба кали нь литийн баруун талд байрладаг. Энэ нь бусад шүлтлэг металлын ионуудтай харьцуулахад литийн ионуудын усжилтын үйл явц маш өндөр энергитэй байдагтай холбоотой юм.
Стандарт исэлдүүлэх потенциалын алгебрийн утга нь харгалзах исэлдсэн хэлбэрийн исэлдэлтийн идэвхийг тодорхойлдог. Тиймээс стандарт исэлдэлтийн потенциалын утгыг харьцуулах нь бидэнд асуултанд хариулах боломжийг олгодог: энэ эсвэл өөр исэлдэлтийн урвал явагддаг уу?
Тиймээс галоген ионуудын исэлдэлтийн бүх хагас урвалууд нь чөлөөт галоген
2 Cl - - 2 e = С l 2 Е 0 = -1.36 В (1)
2 Br - -2e = B r 2 E 0 = -1.07 В (2)
2I - -2 e = I 2 E 0 = -0.54 В (3)
исэлдүүлэгч бодис болгон хар тугалганы ислийг ашиглан стандарт нөхцөлд хийж болно ( IV ) (E 0 = 1.46 В) эсвэл калийн перманганат (E 0 = 1.52 В). Калийн бихроматыг хэрэглэх үед ( E 0 = 1.35 В) зөвхөн (2) ба (3) урвалыг явуулах боломжтой. Эцэст нь азотын хүчлийг исэлдүүлэгч бодис болгон ашиглах ( E 0 = 0.96 В) зөвхөн иодид ионуудын оролцоотой хагас урвалыг зөвшөөрдөг (3).
Тиймээс тодорхой исэлдэлтийн урвалын боломжийг үнэлэх тоон шалгуур нь исэлдэлт ба бууралтын хагас урвалын стандарт исэлдэлтийн потенциалын зөрүүний эерэг утга юм.