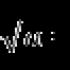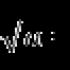H2o به یون تجزیه می شود. ترسیم معادلات واکنش های تبادل یونی. ویژگی های معادلات یونی
آموزش عمومی پایه
خط UMK VV Lunin. شیمی (8-9)
معادلات یونی
معادلات یونی جزء لاینفک یک علم شیمی پیچیده و جالب است. چنین معادلاتی این امکان را فراهم می کند که به صورت بصری ببینیم کدام یون ها وارد تبدیلات شیمیایی می شوند. به شکل یون، موادی ثبت می شوند که تحت تفکیک الکترولیتی قرار می گیرند. بیایید تاریخچه موضوع، الگوریتم تدوین معادلات یونی و مثال هایی از مسائل را تجزیه و تحلیل کنیم.
زمینه
حتی کیمیاگران باستانی که در جستجوی سنگ فیلسوف واکنش های شیمیایی ساده ای انجام می دادند و نتایج تحقیقات خود را در قطعات ضخیم یادداشت می کردند، از علائم خاصی برای مواد شیمیایی استفاده می کردند. هر دانشمند سیستم خاص خود را داشت که جای تعجب نیست: همه می خواستند دانش مخفی خود را از دسیسه های افراد حسود و رقبا محافظت کنند. و فقط در قرن هشتم برای برخی از عناصر نام های یکنواخت وجود دارد.
در سال 1615، ژان بگون، در کتاب خود "اصول شیمی"، که به حق یکی از اولین کتاب های درسی در این بخش از علوم طبیعی به شمار می رود، استفاده از علامت گذاری متعارف را برای نوشتن معادلات شیمیایی پیشنهاد کرد. و تنها در سال 1814، شیمیدان سوئدی، Jons Jakob Berzelius، سیستمی از نمادهای شیمیایی را بر اساس یک یا دو حرف اول نام لاتین عنصر ایجاد کرد، شبیه به چیزی که دانش آموزان در کلاس یاد می گیرند.
در کلاس هشتم (بند 12، کتاب درسی "شیمی. کلاس 8" ویرایش شده توسط V.V. Eremin)، بچه ها یاد گرفتند که چگونه معادلات واکنش مولکولی را بنویسند، جایی که هم معرف ها و هم محصولات واکنش به شکل مولکول ارائه می شوند.
با این حال، این یک دیدگاه ساده شده از تبدیلات شیمیایی است. و دانشمندان قبلاً در قرن 18 به این موضوع فکر کردند.
آرنیوس در نتیجه آزمایش های خود دریافت که محلول های مواد خاصی جریان الکتریکی را هدایت می کنند. و او ثابت کرد که مواد با رسانایی الکتریکی در محلول هایی به شکل یون هستند: کاتیون های با بار مثبت و آنیون های با بار منفی. و این ذرات باردار هستند که واکنش نشان می دهند.
معادلات یونی چیست؟
معادلات واکنش یونی- اینها برابری های شیمیایی هستند که در آنها مواد وارد شده به واکنش و محصولات واکنش ها به عنوان یون های تفکیک شده تعیین می شوند. معادلات از این نوع برای نوشتن واکنش های جایگزینی و تبادل شیمیایی در محلول ها مناسب هستند.
معادلات یونی- بخشی جدایی ناپذیر از یک علم شیمی پیچیده و جالب. چنین معادلاتی این امکان را فراهم می کند که به صورت بصری ببینیم کدام یون ها وارد تبدیلات شیمیایی می شوند. موادی که تحت تفکیک الکترولیتی قرار می گیرند به شکل یون ثبت می شوند (موضوع به تفصیل در پاراگراف 10 کتاب درسی "شیمی. درجه 9" ویرایش شده توسط V.V. Eremin مورد بحث قرار گرفته است). در قالب مولکول ها، گازها، مواد رسوب شده و الکترولیت های ضعیف ثبت می شوند که عملاً تجزیه نمی شوند. گازها با فلش رو به بالا ()، موادی که رسوب می کنند، با فلش رو به پایین (↓) نشان داده می شوند.
کتاب درسی توسط معلمان دانشکده شیمی دانشگاه دولتی مسکو نوشته شده است. M.V. لومونوسوف از ویژگی های بارز کتاب می توان به سادگی و وضوح ارائه مطالب، سطح علمی بالا، تعداد زیادی تصاویر، آزمایش ها و آزمایش های سرگرم کننده اشاره کرد که امکان استفاده از آن را در کلاس ها و مدارس با مطالعه عمیق موضوعات علوم طبیعی فراهم می کند.
ویژگی های معادلات یونی
1. واکنش های تبادل یونی، بر خلاف واکنش های ردوکس، بدون نقض ظرفیت مواد وارد شده به تبدیل های شیمیایی انجام می شود.
![]() - واکنش ردوکس
- واکنش ردوکس
واکنش تبادل یونی
2. واکنشهای بین یونها در شرایطی ادامه مییابد که در طی واکنش یک رسوب با محلول ضعیف تشکیل شود، یک گاز فرار آزاد شود یا الکترولیتهای ضعیف تشکیل شوند.
1 میلی لیتر محلول کربنات سدیم را در لوله آزمایش بریزید و چند قطره اسید کلریدریک را با دقت به آن اضافه کنید.
چه اتفاقی می افتد؟
یک معادله برای واکنش ایجاد کنید، معادلات یونی کامل و خلاصه شده را بنویسید.
#ADVERTISING_INSERT#واکنش های تبادل یونی واکنش هایی در محلول های آبی بین الکترولیت ها هستند که بدون تغییر در حالت اکسیداسیون عناصر تشکیل دهنده آنها انجام می شود.
شرط لازم برای واکنش بین الکترولیت ها (نمک ها، اسیدها و بازها) تشکیل یک ماده با تفکیک کم (آب، اسید ضعیف، هیدروکسید آمونیوم)، یک رسوب یا یک گاز است.
واکنشی را در نظر بگیرید که آب تولید می کند. این واکنش ها شامل تمام واکنش های بین هر اسید و هر باز است. به عنوان مثال، برهمکنش اسید نیتریک با هیدروکسید پتاسیم:
HNO 3 + KOH \u003d KNO 3 + H 2 O (1)
مواد اولیه، یعنی اسید نیتریک و هیدروکسید پتاسیم و همچنین یکی از فرآورده ها، یعنی نیترات پتاسیم، الکترولیت های قوی هستند، یعنی. در محلول آبی، آنها تقریباً منحصراً به شکل یون هستند. آب حاصل متعلق به الکترولیت های ضعیف است، یعنی. عملا به یون تجزیه نمی شود. بنابراین، می توان با نشان دادن وضعیت واقعی مواد در یک محلول آبی، معادله بالا را با دقت بیشتری بازنویسی کرد. به شکل یون:
H + + NO 3 - + K + + OH - \u003d K + + NO 3 - + H 2 O (2)
همانطور که از رابطه (2) مشاهده می شود، هم قبل و هم بعد از واکنش، یون های NO 3- و K + در محلول وجود دارد. به عبارت دیگر در واقع یون های نیترات و یون های پتاسیم به هیچ وجه در واکنش شرکت نکردند. این واکنش تنها به دلیل ترکیب ذرات H + و OH- در مولکول های آب رخ داد. بنابراین، با کاهش جبری یونهای یکسان در رابطه (2):
H + + NO 3 - + K + + OH - \u003d K + + NO 3 - + H 2 O
میگیریمش:
H + + OH - = H 2 O (3)
معادلات شکل (3) نامیده می شوند معادلات یونی کاهش یافته، از شکل (2) - معادلات کامل یونیو به شکل (1) - معادلات واکنش مولکولی.
در واقع، معادله یونی واکنش، ماهیت آن را حداکثر منعکس میکند، دقیقاً چیزی که ادامه آن را ممکن میسازد. لازم به ذکر است که بسیاری از واکنش های مختلف می توانند با یک معادله یونی کاهش یافته مطابقت داشته باشند. در واقع، اگر به عنوان مثال، اسید نیتریک را نه، بلکه اسید کلریدریک را در نظر بگیریم، و مثلاً از هیدروکسید باریم به جای هیدروکسید پتاسیم استفاده کنیم، معادله واکنش مولکولی زیر را خواهیم داشت:
2HCl + Ba(OH) 2 = BaCl 2 + 2H 2 O
اسید کلریدریک، هیدروکسید باریم و کلرید باریم الکترولیت های قوی هستند، یعنی در محلول عمدتا به شکل یون وجود دارند. همانطور که در بالا ذکر شد، آب یک الکترولیت ضعیف است، یعنی تقریباً منحصراً به شکل مولکول در محلول وجود دارد. به این ترتیب، معادله یونی کاملاین واکنش به شکل زیر خواهد بود:
2H + + 2Cl - + Ba 2+ + 2OH - = Ba 2+ + 2Cl - + 2H 2 O
همان یون های چپ و راست را کاهش می دهیم و به دست می آوریم:
2H + + 2OH - = 2H 2 O
با تقسیم دو سمت چپ و راست بر 2 به دست می آید:
H + + OH - \u003d H 2 O،
اخذ شده معادله یونی کاهش یافتهبه طور کامل با معادله یونی کاهش یافته برهمکنش اسید نیتریک و هیدروکسید پتاسیم منطبق است.
هنگام کامپایل معادلات یونی به شکل یون، فقط فرمول ها نوشته می شود:
1) اسیدهای قوی (HCl، HBr، HI، H 2 SO 4، HNO 3، HClO 4) (لیست اسیدهای قوی باید یاد بگیرید!)
2) بازهای قوی (هیدروکسیدهای قلیایی (ALH) و فلزات قلیایی خاکی (ALHM))
3) نمک های محلول
در فرم مولکولی، فرمول ها نوشته می شوند:
1) آب H 2 O
2) اسیدهای ضعیف (H 2 S ، H 2 CO 3 ، HF ، HCN ، CH 3 COOH (و سایرین ، تقریباً همه آلی)).
3) بازهای ضعیف (NH 4 OH و تقریباً تمام هیدروکسیدهای فلزی به جز فلزات قلیایی و فلزات قلیایی خاکی.
4) نمکهای کمی محلول (↓) ("M" یا "H" در جدول حلالیت).
5) اکسیدها (و سایر موادی که الکترولیت نیستند).
بیایید سعی کنیم معادله بین هیدروکسید آهن (III) و اسید سولفوریک را بنویسیم. در شکل مولکولی معادله برهمکنش آنها به صورت زیر نوشته می شود:
2Fe(OH) 3 + 3H 2 SO 4 = Fe 2 (SO 4) 3 + 6H 2 O
هیدروکسید آهن (III) مطابق با نام "H" در جدول حلالیت است که به ما در مورد نامحلول بودن آن می گوید، یعنی. در معادله یونی باید به طور کامل نوشته شود، یعنی. به صورت Fe(OH) 3. اسید سولفوریک محلول است و متعلق به الکترولیت های قوی است، یعنی در محلول عمدتاً در حالت تفکیک وجود دارد. سولفات آهن (III) مانند تقریباً تمام نمک های دیگر، یک الکترولیت قوی است و از آنجایی که در آب محلول است، باید در معادله یونی به صورت یون درج شود. با در نظر گرفتن تمام موارد فوق، یک معادله یونی کامل به شکل زیر بدست می آوریم:
2Fe(OH) 3 + 6H + + 3SO 4 2- = 2Fe 3+ + 3SO 4 2- + 6H 2 O
با کاهش یون های سولفات در سمت چپ و راست، به دست می آوریم:
2Fe(OH) 3 + 6H + = 2Fe 3+ + 6H 2 O
با تقسیم دو طرف معادله بر 2، معادله یونی کاهش یافته را بدست می آوریم:
Fe(OH) 3 + 3H + = Fe 3 + + 3H 2 O
حال بیایید به واکنش تبادل یونی که منجر به تشکیل یک رسوب می شود نگاه کنیم. به عنوان مثال، برهمکنش دو نمک محلول:
هر سه نمک - کربنات سدیم، کلرید کلسیم، کلرید سدیم و کربنات کلسیم (بله، بله، و او نیز) - الکترولیت های قوی هستند و همه چیز به جز کربنات کلسیم در آب محلول است، یعنی. در این واکنش به شکل یون ها درگیر می شوند:
2Na + + CO 3 2- + Ca 2 + + 2Cl - = CaCO 3 ↓ + 2Na + + 2Cl -
با کاهش یون های یکسان در سمت چپ و راست در این معادله، یونی اختصاری را بدست می آوریم:
CO 3 2- + Ca 2 + \u003d CaCO 3 ↓
آخرین معادله دلیل برهمکنش محلول های کربنات سدیم و کلرید کلسیم را نشان می دهد. یونهای کلسیم و یونهای کربنات به مولکولهای کربنات کلسیم خنثی ترکیب میشوند که وقتی با یکدیگر ترکیب میشوند، بلورهای کوچکی از رسوب CaCO 3 با ساختار یونی ایجاد میکنند.
نکته مهم برای قبولی در امتحان شیمی
برای اینکه واکنش نمک 1 با نمک 2 ادامه یابد، علاوه بر الزامات اساسی برای وقوع واکنش های یونی (گاز، رسوب یا آب در محصولات واکنش)، یک الزام دیگر برای چنین واکنش هایی اعمال می شود - نمک های اولیه باید محلول یعنی مثلا
CuS + Fe (NO 3) 2 ≠ FeS + Cu (NO 3) 2
واکنش نمی رود، اگرچه FeS - به طور بالقوه می تواند یک رسوب ایجاد کند، زیرا. نامحلول دلیل اینکه واکنش ادامه نمی یابد، حل نشدن یکی از نمک های شروع کننده (CuS) است.
و در اینجا، برای مثال،
Na 2 CO 3 + CaCl 2 \u003d CaCO 3 ↓ + 2 NaCl
حاصل می شود، زیرا کربنات کلسیم نامحلول است و نمک های اصلی محلول هستند.
همین امر در مورد برهمکنش نمک ها با بازها نیز صدق می کند. علاوه بر الزامات اساسی برای وقوع واکنش های تبادل یونی، برای واکنش نمک با باز، حلالیت هر دوی آنها ضروری است. به این ترتیب:
Cu(OH) 2 + Na 2 S - جریان نمی یابد
زیرا Cu(OH) 2 نامحلول است، اگرچه محصول بالقوه CuS یک رسوب است.
اما واکنش بین NaOH و Cu (NO 3) 2 ادامه دارد، بنابراین هر دو ماده اولیه محلول هستند و Cu (OH) 2 را رسوب می دهند:
2NaOH + Cu(NO 3) 2 = Cu(OH) 2 ↓+ 2NaNO3
توجه! به هیچ وجه نیاز به حلالیت مواد اولیه را فراتر از واکنش نمک 1 + نمک 2 و نمک + پایه گسترش ندهید.
به عنوان مثال، در مورد اسیدها، این نیاز ضروری نیست. به طور خاص، تمام اسیدهای محلول با تمام کربنات ها، از جمله اسیدهای نامحلول، کاملاً واکنش می دهند.
به عبارت دیگر:
1) نمک 1 + نمک 2 - اگر نمک های اولیه محلول باشند و در محصولات رسوب وجود داشته باشد واکنش ادامه می یابد.
2) نمک + هیدروکسید فلز - اگر مواد اولیه محلول باشند و در محصولات رسوب یا هیدروکسید آمونیوم وجود داشته باشد واکنش ادامه می یابد.
اجازه دهید شرط سوم برای وقوع واکنش های تبادل یونی را در نظر بگیریم - تشکیل گاز. به طور دقیق، فقط در نتیجه تبادل یونی، تشکیل گاز فقط در موارد نادر امکان پذیر است، به عنوان مثال، در تشکیل سولفید هیدروژن گازی:
K2S + 2HBr = 2KBr + H2S
در بیشتر موارد دیگر، گاز در نتیجه تجزیه یکی از محصولات واکنش تبادل یونی تشکیل می شود. به عنوان مثال، باید در چارچوب امتحان مطمئن باشید که با تشکیل گاز، به دلیل ناپایداری، محصولاتی مانند H 2 CO 3، NH 4 OH و H 2 SO 3 تجزیه می شوند:
H 2 CO 3 \u003d H 2 O + CO 2
NH 4 OH \u003d H 2 O + NH 3
H 2 SO 3 \u003d H 2 O + SO 2
به عبارت دیگر، اگر در نتیجه تبادل یونی اسید کربنیک، هیدروکسید آمونیوم یا اسید سولفوریک تشکیل شود، واکنش تبادل یونی به دلیل تشکیل یک محصول گازی ادامه می یابد:
اجازه دهید معادلات یونی را برای تمام واکنش های فوق که منجر به تشکیل گازها می شود، بنویسیم. 1) برای واکنش:
K2S + 2HBr = 2KBr + H2S
به صورت یونی، سولفید پتاسیم و برومید پتاسیم ثبت خواهد شد، زیرا. نمک های محلول، و همچنین اسید هیدروبرومیک، tk. به اسیدهای قوی اشاره دارد. سولفید هیدروژن که گازی کم محلول و تجزیه ضعیف به یون است، به شکل مولکولی نوشته می شود:
2K + + S 2- + 2H + + 2Br - \u003d 2K + + 2Br - + H 2 S
با کاهش یون های مشابه، به دست می آوریم:
S 2- + 2H + = H 2 S
2) برای معادله:
Na 2 CO 3 + H 2 SO 4 \u003d Na 2 SO 4 + H 2 O + CO 2
در شکل یونی، Na 2 CO 3، Na 2 SO 4 به عنوان نمک های بسیار محلول و H 2 SO 4 به عنوان یک اسید قوی نوشته می شود. آب یک ماده با تفکیک کم است و CO 2 به هیچ وجه الکترولیت نیست، بنابراین فرمول آنها به شکل مولکولی نوشته می شود:
2Na + + CO 3 2- + 2H + + SO 4 2- \u003d 2Na + + SO 4 2 + H 2 O + CO 2
CO 3 2- + 2H + = H 2 O + CO 2
3) برای معادله:
NH 4 NO 3 + KOH \u003d KNO 3 + H 2 O + NH 3
مولکول های آب و آمونیاک به طور کلی ثبت می شوند و NH 4 NO 3 ، KNO 3 و KOH به شکل یونی ثبت می شوند، زیرا همه نیترات ها نمک های بسیار محلول هستند و KOH یک هیدروکسید فلز قلیایی است، به عنوان مثال. پایه قوی:
NH 4 + + NO 3 - + K + + OH - = K + + NO 3 - + H 2 O + NH 3
NH 4 + + OH - \u003d H 2 O + NH 3
برای معادله:
Na 2 SO 3 + 2HCl \u003d 2NaCl + H 2 O + SO 2
معادله کامل و خلاصه شده به صورت زیر خواهد بود:
2Na + + SO 3 2- + 2H + + 2Cl - = 2Na + + 2Cl - + H 2 O + SO 2
اکسیدها شامل H 2 O، رسوبات (جدول حلالیت)، ترکیبات با تفکیک ضعیف: H2S. HNO 2، H 2 SO 3 → SO 2 + H 2 O، H 2 CO 3 → CO 2 + H 2 O، NH 4 OH → NH 3 + H 2 O . CH3COOH; HMnO 4 H 2 SiO 3 ، H 3 PO 4
موارد زیر حالت اکسیداسیون ثابت دارند:
گروه I زیر گروه اصلی +1، گروه دوم زیر گروه اصلی +2، H +، O -2، OH -، Al 3+، Zn 2+.
واکنش های ردوکس(ORD) واکنش هایی هستند که در آن عناصر با انتقال الکترون ها حالت اکسیداسیون (CO) خود را تغییر می دهند.
الگوریتم حل واکنش های ردوکس
حالت اکسیداسیون (CO) هر عنصر را در واکنش پایین می آوریم.
عناصری را پیدا کنید که حالت اکسیداسیون خود را تغییر می دهند.
ما یون ها یا مولکول هایی را انتخاب می کنیم که حاوی عناصری با درجه اکسیداسیون تغییر یافته باشند.
ما عامل اکسید کننده، عامل کاهنده را امضا می کنیم.

محیط ترش: اضافه کردن nH 2 O، که در آن عدم O → 2nH +
محیط قلیایی: nH 2 O را اضافه کنید، جایی که O → 2nOH اضافی -
هر نیمه واکنش را برابر می کنیم (سمت چپ نیمه واکنش = سمت راست)، تعداد الکترون های داده شده و دریافتی را یادداشت می کنیم.
تعداد الکترون های دریافتی و داده شده را برابر می کنیم، ضرایب را در مقابل نیمه واکنش ها قرار می دهیم.
ما فرآیند اکسیداسیون و فرآیند بازیابی را امضا می کنیم.
معادله یونی کل را با در نظر گرفتن ضرایب می نویسیم.
ضرایب را از یونی به معادله مولکولی منتقل می کنیم، ضرایب مشابه را می دهیم (سمت چپ واکنش = راست)
|
خوردگی: اکسیداسیون (تخریب) فلز تحت تأثیر محیط آند در سری ولتاژهای فلزی در سمت چپ قرار دارد. کاتد در سمت راست است. پوشش آند (به سمت چپ در سری ولتاژ؛ بهتر است،زیرا لایه بالایی از بین رفته است). پوشش کاتد (سمت راست در سری ولتاژ). |
|
|
محیط مرطوب، محیط قلیایی |
/A/: Me 0 – nē→Me n + فرآیند اکسیداسیون /K/: 1/2O 2 +H 2 O + 2ē→2OH - فرآیند اکسیداسیون |
|
محیط اسیدی |
/K/: 2H + +2ē→H 2 - فرآیند اکسیداسیون |
|
در مثال خوردگی Fe-Cu A (Fe): Fe 0 -2e → Fe 2+ K (Cu): 1 / 2O 2 + H 2 O + 2e → 2OH - - محیط مرطوب، محیط قلیایی K(Cu): 2H + +2e→H2 - اسیدی محصولات: در یک محیط قلیایی 4Fe (OH) 2 + O 2 + 2H 2 O \u003d 4 Fe (OH) 3، Fe(OH) 3 → Fe 2 O 3 + H 2 O. (زنگ) محصولات در محیط اسیدی: FeSO 4 |
|

http://ru.wikipedia.org/wiki/%DD%EB%E5%EA%F2%F0%EE%EB%E8%E7
طبق قانون فارادی: m \u003d EIt / 96 500، Q \u003d آن، C (برق مصرف شده)
که در آن m جرم ماده اکسید شده یا کاهش یافته در الکترود است. E جرم معادل ماده است. I - قدرت فعلی، A. t مدت زمان الکترولیز، s است. Ve H 2 \u003d 11.2 لیتر، Ve O 2 \u003d 5.6 لیتر

برای به خاطر سپردن فرآیندهای کاتدی و آند در الکتروشیمی، قانون یادگاری زیر وجود دارد:
آنیون ها در آند اکسید می شوند.
در کاتد، کاتیون ها احیا می شوند.
در خط اول، همه کلمات با یک مصوت شروع می شوند، در خط دوم - با یک صامت.
یا ساده تر:
کاتد - کاتیون ها (یون ها در کاتد)
ANod - آنیون ها (یون ها در آند)
موضوع: پیوند شیمیایی تفکیک الکترولیتی
درس: نوشتن معادلات برای واکنش های تبادل یونی
بیایید یک معادله برای واکنش بین هیدروکسید آهن (III) و اسید نیتریک ایجاد کنیم.
Fe(OH) 3 + 3HNO 3 = Fe(NO 3) 3 + 3H 2 O
(هیدروکسید آهن (III) یک باز نامحلول است، بنابراین در معرض آن قرار نمی گیرد. آب ماده ای است که تفکیک ضعیفی دارد و عملاً در محلول به یون تبدیل نمی شود.)
Fe(OH) 3 + 3H + + 3NO 3 - = Fe 3 + + 3NO 3 - + 3H 2 O
همان تعداد آنیون نیترات را در سمت چپ و راست خط بزنید، معادله یونی اختصاری را بنویسید:
Fe(OH) 3 + 3H + = Fe 3 + + 3H 2 O
این واکنش تا انتها ادامه دارد، زیرا یک ماده با تفکیک ضعیف، آب، تشکیل می شود.
بیایید یک معادله برای واکنش بین کربنات سدیم و نیترات منیزیم بنویسیم.
Na 2 CO 3 + Mg (NO 3) 2 \u003d 2NaNO 3 + MgCO 3 ↓
این معادله را به صورت یونی می نویسیم:
(کربنات منیزیم در آب نامحلول است و بنابراین به یون تجزیه نمی شود.)
2Na + + CO 3 2- + Mg 2 + + 2NO 3 - = 2Na + + 2NO 3 - + MgCO 3 ↓
همان تعداد آنیون نیترات و کاتیون های سدیم را در سمت چپ و راست خط می زنیم، معادله یونی اختصاری را می نویسیم:
CO 3 2- + Mg 2 + \u003d MgCO 3 ↓
این واکنش تا انتها ادامه دارد، زیرا یک رسوب تشکیل می شود - کربنات منیزیم.
بیایید یک معادله برای واکنش بین کربنات سدیم و اسید نیتریک بنویسیم.
Na 2 CO 3 + 2HNO 3 \u003d 2NaNO 3 + CO 2 + H 2 O
(دی اکسید کربن و آب محصولات تجزیه کربنیک اسید ضعیف حاصله هستند.)
2Na + + CO 3 2- + 2H + + 2NO 3 - = 2Na + + 2NO 3 - + CO 2 + H 2 O
CO 3 2- + 2H + = CO 2 + H 2 O
این واکنش تا انتها ادامه دارد، زیرا در نتیجه گاز آزاد می شود و آب تشکیل می شود.
بیایید دو معادله واکنش مولکولی ایجاد کنیم که با معادله یونی مختصر زیر مطابقت دارد: Ca 2 + + CO 3 2- = CaCO 3 .
معادله یونی خلاصه شده جوهر واکنش تبادل یونی را نشان می دهد. در این مورد، می توان گفت که برای به دست آوردن کربنات کلسیم، لازم است که ترکیب ماده اول شامل کاتیون های کلسیم و ترکیب دوم - آنیون های کربنات باشد. اجازه دهید معادلات مولکولی واکنش هایی را بسازیم که این شرط را برآورده می کند:
CaCl 2 + K 2 CO 3 \u003d CaCO 3 ↓ + 2KCl
Ca(NO 3) 2 + Na 2 CO 3 = CaCO 3 ↓ + 2 NaNO 3
1. Orzhekovsky P.A. شیمی: پایه نهم: کتاب درسی. برای ژنرال inst / پ.ا. اورژکوفسکی، L.M. مشچریاکووا، ال.اس. پونتاک - M.: AST: Astrel، 2007. (§17)
2. Orzhekovsky P.A. شیمی: پایه نهم: کتاب درسی آموزش عمومی. inst / پ.ا. اورژکوفسکی، L.M. مشچریاکووا، م.م. شالاشووا - M.: Astrel، 2013. (§ 9)
3. رودزیتیس جی.ای. شیمی: غیر آلی. علم شیمی. عضو. شیمی: کتاب درسی. برای 9 سلول / GE. رودزیتیس، F.G. فلدمن - M .: آموزش، JSC "کتب درسی مسکو"، 2009.
4. Khomchenko I.D. مجموعه مسائل و تمرینات شیمی دبیرستان. - M.: RIA "موج جدید": ناشر Umerenkov، 2008.
5. دایره المعارف برای کودکان. جلد 17. شیمی / فصل. ویرایش V.A. ولودین، پیشرو. علمی ویرایش آی. لینسون. - M.: آوانتا +، 2003.
منابع وب اضافی
1. مجموعه واحدی از منابع آموزشی دیجیتال (تجارب ویدیویی در مورد موضوع): ().
2. نسخه الکترونیکی مجله "شیمی و زندگی": ().
مشق شب
1. در جدول با علامت بعلاوه جفت موادی را که بین آنها واکنش تبادل یونی امکان پذیر است علامت بزنید تا به آخر بروید. معادلات واکنش را به صورت مولکولی، کامل و یونی احیا شده بنویسید.
|
مواد واکنش دهنده |
ک2 CO3 |
AgNO3 |
FeCl3 |
HNO3 |
|
|
CuCl2 |
|||||
2. با. 67 شماره 10،13 از P.A. Orzhekovsky "شیمی: کلاس نهم" / P.A. اورژکوفسکی، L.M. مشچریاکووا، م.م. شالاشووا - M.: Astrel، 2013.
اغلب، دانش آموزان و دانش آموزان باید به اصطلاح را تشکیل دهند. معادلات واکنش یونی به طور خاص، مسئله 31، پیشنهاد شده در آزمون دولتی واحد در شیمی، به این موضوع اختصاص دارد. در این مقاله به طور مفصل به الگوریتم نوشتن معادلات یونی کوتاه و کامل می پردازیم، نمونه های زیادی از سطوح مختلف پیچیدگی را تحلیل خواهیم کرد.
چرا معادلات یونی مورد نیاز است
اجازه دهید به شما یادآوری کنم که وقتی بسیاری از مواد در آب حل می شوند (و نه تنها در آب!) فرآیند تجزیه رخ می دهد - مواد به یون تجزیه می شوند. به عنوان مثال، مولکول های HCl در یک محیط آبی به کاتیون های هیدروژن (H + ، به طور دقیق تر، H 3 O +) و آنیون های کلر (Cl -) تجزیه می شوند. برمید سدیم (NaBr) در یک محلول آبی نه به شکل مولکول، بلکه به شکل یون های هیدراته Na + و Br - است (به هر حال، یون ها در برمید سدیم جامد نیز وجود دارند).
هنگام نوشتن معادلات "معمولی" (مولکولی)، ما در نظر نمی گیریم که مولکول ها وارد واکنش نمی شوند، بلکه یون ها وارد واکنش می شوند. برای مثال، در اینجا معادله واکنش بین اسید کلریدریک و هیدروکسید سدیم است:
HCl + NaOH = NaCl + H 2 O. (1)
البته این نمودار به درستی فرآیند را توصیف نمی کند. همانطور که قبلاً گفتیم، عملاً هیچ مولکول HCl در محلول آبی وجود ندارد، اما یون های H + و Cl - وجود دارد. همین امر در مورد NaOH نیز صادق است. بهتر است موارد زیر را بنویسید:
H + + Cl - + Na + + OH - = Na + + Cl - + H 2 O. (2)
همین است معادله یونی کامل. به جای مولکول های "مجازی"، ما ذرات موجود در محلول (کاتیون ها و آنیون ها) را می بینیم. ما روی این سوال نمی مانیم که چرا H 2 O را به شکل مولکولی نوشته ایم. در این مورد کمی بعد توضیح داده خواهد شد. همانطور که می بینید، هیچ چیز پیچیده ای وجود ندارد: ما مولکول ها را با یون هایی که در حین تفکیک آنها تشکیل می شوند، جایگزین کرده ایم.
با این حال، حتی معادله یونی کامل نیز کامل نیست. در واقع، نگاه دقیق تری بیندازید: هم در سمت چپ و هم در قسمت راست معادله (2) ذرات یکسان - کاتیون های Na + و آنیون های کلر وجود دارد. این یون ها در طول واکنش تغییر نمی کنند. پس چرا اصلاً به آنها نیاز است؟ بیایید آنها را حذف کنیم و دریافت کنیم معادله یونی کوتاه:
H + + OH - = H 2 O. (3)
همانطور که می بینید، همه چیز به برهمکنش یون های H + و OH - با تشکیل آب می رسد (واکنش خنثی سازی).
تمام معادلات یونی کامل و کوتاه نوشته شده است. اگر مشکل 31 را در امتحان شیمی حل می کردیم، حداکثر نمره آن را می گرفتیم - 2 امتیاز.
بنابراین، یک بار دیگر در مورد اصطلاحات:
- HCl + NaOH = NaCl + H 2 O - معادله مولکولی (معادله "معمول" که به طور شماتیک ماهیت واکنش را منعکس می کند).
- H + + Cl - + Na + + OH - = Na + + Cl - + H 2 O - معادله یونی کامل (ذرات واقعی در محلول قابل مشاهده هستند).
- H + + OH - = H 2 O - یک معادله یونی کوتاه (ما تمام "زباله ها" - ذراتی که در فرآیند شرکت نمی کنند را حذف کردیم).
الگوریتم نوشتن معادلات یونی
- معادله مولکولی واکنش را می سازیم.
- تمام ذراتی که در محلول به میزان قابل توجهی تفکیک می شوند به صورت یون نوشته می شوند. موادی را که مستعد تجزیه نیستند، "به شکل مولکول" ترک می کنیم.
- از دو قسمت معادله به اصطلاح حذف می کنیم. یون های ناظر، یعنی ذراتی که در فرآیند شرکت نمی کنند.
- ضرایب را بررسی می کنیم و پاسخ نهایی را می گیریم - یک معادله یونی کوتاه.
مثال 1. یک معادله یونی کامل و کوتاه که برهمکنش محلول های آبی کلرید باریم و سولفات سدیم را توصیف می کند، بنویسید.
راه حل. ما مطابق با الگوریتم پیشنهادی عمل خواهیم کرد. بیایید ابتدا معادله مولکولی را تنظیم کنیم. کلرید باریم و سولفات سدیم دو نمک هستند. بیایید به بخش کتاب مرجع "خواص ترکیبات معدنی" نگاه کنیم. می بینیم که نمک ها می توانند با یکدیگر تعامل داشته باشند اگر در طی واکنش رسوبی تشکیل شود. بیایید بررسی کنیم:
تمرین 2. معادلات واکنش های زیر را کامل کنید:
- KOH + H 2 SO 4 \u003d
- H 3 PO 4 + Na 2 O \u003d
- Ba(OH) 2 + CO 2 =
- NaOH + CuBr 2 =
- K 2 S + Hg (NO 3) 2 \u003d
- Zn + FeCl 2 =
تمرین 3. معادلات مولکولی واکنش های (در محلول آبی) بین: الف) کربنات سدیم و اسید نیتریک، ب) نیکل (II) کلرید و هیدروکسید سدیم، ج) اسید فسفریک و هیدروکسید کلسیم، د) نیترات نقره و کلرید پتاسیم، e. ) اکسید فسفر (V) و هیدروکسید پتاسیم.
من صمیمانه امیدوارم که برای انجام این سه کار مشکلی نداشته باشید. اگر اینطور نیست، لازم است به مبحث "خواص شیمیایی طبقات اصلی ترکیبات معدنی" برگردیم.
چگونه یک معادله مولکولی را به یک معادله یونی کامل تبدیل کنیم؟
جالب ترین شروع می شود. ما باید بفهمیم که چه موادی باید به صورت یون نوشته شوند و چه موادی باید به "شکل مولکولی" رها شوند. شما باید موارد زیر را به خاطر بسپارید.
به شکل یون بنویسید:
- نمک های محلول (تاکید می کنم که فقط نمک ها در آب بسیار محلول هستند).
- قلیاها (اجازه دهید یادآوری کنم که بازهای محلول در آب قلیایی نامیده می شوند ، اما NH 4 OH نیستند).
- اسیدهای قوی (H 2 SO 4 , HNO 3 , HCl , HBr , HI , HClO 4 , HClO 3 , H 2 SeO 4 , ...).
همانطور که می بینید، یادآوری این لیست آسان است: شامل اسیدها و بازهای قوی و همه نمک های محلول است. به هر حال، به ویژه شیمیدانان جوان هوشیار که ممکن است از این واقعیت خشمگین شوند که الکترولیت های قوی (نمک های نامحلول) در این لیست گنجانده نشده اند، می توانم موارد زیر را به شما بگویم: عدم قرار دادن نمک های نامحلول در این لیست به هیچ وجه رد نمی شود. واقعیت این است که آنها الکترولیت های قوی هستند.
تمام مواد دیگر باید در معادلات یونی به صورت مولکول وجود داشته باشند. برای آن دسته از خوانندگان مطالبهای که از عبارت مبهم «همه مواد دیگر» راضی نیستند و با الگوبرداری از قهرمان یک فیلم معروف، خواستار «اعلام فهرست کامل» هستند، اطلاعات زیر را میدهم.
به شکل مولکول بنویسید:
- تمام نمک های نامحلول؛
- همه بازهای ضعیف (از جمله هیدروکسیدهای نامحلول، NH 4 OH و مواد مشابه)؛
- تمام اسیدهای ضعیف (H 2 CO 3 ، HNO 2 ، H 2 S ، H 2 SiO 3 ، HCN ، HClO ، تقریباً تمام اسیدهای آلی ...)
- به طور کلی، تمام الکترولیت های ضعیف (از جمله آب!!!)؛
- اکسیدها (همه انواع)؛
- تمام ترکیبات گازی (به ویژه H 2 , CO 2 , SO 2 , H 2 S , CO ) .
- مواد ساده (فلزات و غیر فلزات)؛
- تقریبا تمام ترکیبات آلی (به استثنای نمک های محلول در آب اسیدهای آلی).
وای، فکر نمی کنم چیزی را فراموش کرده باشم! اگرچه به نظر من، به خاطر سپردن لیست شماره 1 آسان تر است.
بیایید تمرین کنیم!
مثال 2. یک معادله یونی کامل برای توصیف برهمکنش هیدروکسید مس (II) و اسید کلریدریک بسازید.
راه حل. البته بیایید با معادله مولکولی شروع کنیم. هیدروکسید مس (II) یک باز نامحلول است. همه بازهای نامحلول با اسیدهای قوی واکنش داده و نمک و آب تشکیل می دهند:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O.
و اکنون متوجه می شویم که کدام مواد را به شکل یون و کدام - به شکل مولکول بنویسیم. لیست های بالا به ما کمک خواهند کرد. هیدروکسید مس (II) یک پایه نامحلول است (به جدول حلالیت مراجعه کنید)، یک الکترولیت ضعیف. بازهای نامحلول به شکل مولکولی نوشته می شوند. HCl یک اسید قوی است، در محلول تقریباً به طور کامل به یون تجزیه می شود. CuCl 2 یک نمک محلول است. به شکل یونی می نویسیم. آب - فقط به شکل مولکول! معادله یونی کامل را بدست می آوریم:
Cu (OH) 2 + 2H + + 2Cl - \u003d Cu 2+ + 2Cl - + 2H2 O.
مثال 3. یک معادله یونی کامل برای واکنش دی اکسید کربن با محلول آبی NaOH بنویسید.
راه حل. دی اکسید کربن یک اکسید اسیدی معمولی است، NaOH یک قلیایی است. هنگامی که اکسیدهای اسیدی با محلول های آبی قلیایی تعامل می کنند، نمک و آب تشکیل می شود. ما معادله واکنش مولکولی را می سازیم (به هر حال، ضرایب را فراموش نکنید):
CO 2 + 2NaOH \u003d Na 2 CO 3 + H 2 O.
CO 2 - اکسید، ترکیب گازی؛ شکل مولکولی را حفظ کنید NaOH - پایه قوی (قلیایی)؛ به شکل یون نوشته شده است. Na 2 CO 3 - نمک محلول؛ به شکل یون بنویسید آب یک الکترولیت ضعیف است، عملاً تجزیه نمی شود. آن را به شکل مولکولی بگذارید. موارد زیر را دریافت می کنیم:
CO 2 + 2Na + + 2OH - \u003d Na 2+ + CO 3 2- + H 2 O.
مثال 4. سولفید سدیم در محلول آبی با کلرید روی واکنش داده و رسوب تشکیل می دهد. معادله یونی کامل این واکنش را بنویسید.
راه حل. سولفید سدیم و کلرید روی نمک هستند. هنگامی که این نمک ها برهم کنش دارند، سولفید روی رسوب می کند:
Na 2 S + ZnCl 2 \u003d ZnS ↓ + 2NaCl.
من بلافاصله معادله یونی کامل را می نویسم و شما خودتان آن را تجزیه و تحلیل خواهید کرد:
2Na + + S 2- + Zn 2+ + 2Cl - = ZnS↓ + 2Na + + 2Cl - .
من چندین کار برای کار مستقل و یک تست کوچک به شما پیشنهاد می کنم.
تمرین 4. معادلات مولکولی و یونی کامل واکنش های زیر را بنویسید:
- NaOH + HNO3 =
- H 2 SO 4 + MgO =
- Ca(NO 3) 2 + Na 3 PO 4 =
- CoBr 2 + Ca(OH) 2 =
تمرین 5. معادلات یونی کاملی را بنویسید که برهمکنش: الف) اکسید نیتریک (V) با محلول آبی هیدروکسید باریم، ب) محلول هیدروکسید سزیم با اسید هیدرویدیک، ج) محلول های آبی سولفات مس و سولفید پتاسیم، د) هیدروکسید کلسیم را بنویسید. و محلول آبی نیترات آهن (III).