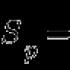Bereiche der metallischen und chemischen Eigenschaften von Mangan. Mangan (chemisches Element)
Mangan ist ein wertvolles Metall für den Menschen.
Die chemischen Eigenschaften von Mangan bestimmen seine weite Verbreitung als Rohstoff für die industrielle Herstellung hochwertiger Legierungen. Die Verbindungen des Elements werden in der Medizin und Landwirtschaft verwendet.
Physikalische und chemische Eigenschaften von Metall
- Zum ersten Mal wurde ein chemisches Element von schwedischen Chemikern in Eisenerz entdeckt. Es wurde durch Erhitzen einer Mischung aus Erzmaterial mit Kohle gewonnen. Als Ergebnis wurde ein Metallbauteil gewonnen, das seinen Namen von dem deutschen Wort für „Manganerz“ hat.
- Das chemische Element gehört zu einer Reihe von Übergangselementen und kann Verbindungen bilden, die Atome in der Oxidationsstufe 0 enthalten. Beim Erhitzen hat es die Eigenschaft, Wasserstoff zu verdrängen und Wasser zu zersetzen.
- In der Natur kommt dieses spröde Metall, das sich durch eine silbrige Farbe auszeichnet, nur in Verbindungen vor. Es wird aus Erzrohstoffen gewonnen, unter denen die folgenden Arten am häufigsten vorkommen: Pyrolusit, Manganit, Psilomelan, Brownit.
- Das Metall kommt in Manganknollen vor, die am Grund der Ozeane gefunden werden. Die Technologie, sie aus dem Boden zu extrahieren, ist mit der Verwendung spezieller Geräte verbunden und nicht industrieller Natur.
- Mangan bildet durch Oxidation an der Luft leicht Oxide. Je nach Änderung des Temperaturgradienten beim Erhitzen reagiert es mit Stickstoff, Schwefel, Silizium. Bei der Aufnahme von Wasserstoff bildet Mangan feste Lösungen.
- Es ist schwierig, sich bei normaler Raumtemperatur in Wasser aufzulösen. In konzentrierten Säuren löst es sich beim Erhitzen auf und bildet Salze.
- Das chemische Element Nr. 25 zeichnet sich durch seine Aktivität bei Metallreduktionsreaktionen aus Oxiden aus. Es verdrängt Metalle und bildet mit Sauerstoff eine Verbindung.
Technologie zur Extraktion chemischer Elemente
Die wichtigsten Metallproduzenten und -lieferanten für den Weltmarkt sind Brasilien, Australien, Südafrika und die Ukraine. In diesen Ländern befinden sich Erzvorkommen, die fast 73% der Welt ausmachen.
Die Produktion von Eisenmetallen im industriellen Maßstab beginnt mit der Gewinnung von Erzen und deren Anreicherung und ist auf Metallverbindungen mit anderen Elementen angewiesen. Herkömmliches Carbonaterz wird beispielsweise vorkalziniert. In einigen Fällen wird es mit Schwefelsäure ausgelaugt, gefolgt von einer thermischen Reduktion mit Koks. Manchmal wird Aluminium oder Silizium verwendet, um das Metall wiederherzustellen.

Chemische Verfahren zur Gewinnung von Mangan.
Reines Metall wird durch Elektrolyse aus wässrigen Lösungen von Mangansulfat extrahiert.
Die Verwendung von Mangan in der industriellen Produktion
- Der Hauptteil des Metalls wird für den Bedarf der Eisenmetallurgie als Zusatzstoff verwendet, und sein Verbrauch liegt weltweit an vierter Stelle nach den Hauptrohstoffen Eisen, Aluminium und Kupfer. Mangan ist ein wesentliches Element, das in allen Arten von Gusseisen und Stahl vorhanden ist. Die einzigartige Eigenschaft von Mangan, mit den meisten Metallen Legierungen zu bilden, wird genutzt zur Herstellung von:
- verschiedene Sorten von Manganstahl;
- Manganit (eine Legierung, in der es kein Eisen gibt).

Andere Metallanwendungen
Die Eigenschaften eines chemischen Elements und seiner Verbindungen werden in der industriellen Produktion genutzt:
- als Katalysator für organische Reaktionen;
- zum Abbau anorganischer Salze;
- für die Glasherstellung;
- beim Beschichten von Metalloberflächen;
- in der Keramikindustrie zum Einfärben von Glasuren und Emails
- zur Adsorption von Schadstoffen;
- zum Bleichen von Naturmaterialien (Leinen, Wolle).
Abfälle, die bei der Verarbeitung von Metallrohstoffen unter Beteiligung von Mangan anfallen, werden in der Landwirtschaft verwendet, um den Boden für Kulturpflanzen mit einer wertvollen Komponente anzureichern.
Die Chemie dieses Elements spielt in der Medizin eine wichtige Rolle.
Mangansalze werden verwendet, um eine antiseptische wässrige Lösung zum Waschen von Wunden und zur Behandlung von Verbrennungen zu bilden.
Das chemische Element Nr. 25 ist für die normale Funktion des Körpers, die Regulierung des Blutzuckerspiegels, die Vorbeugung von Diabetes mellitus und die Gewährleistung der normalen Funktion der Bauchspeicheldrüse erforderlich.
Der Mangel an Mangan im menschlichen Körper kann Krankheiten verursachen. Der tägliche Bedarf des Menschen an einem wichtigen Spurenelement liegt bei knapp 10 mg. Seine Quellen für den Körper sind Nahrung:

Einige Insekten- und Pflanzenarten sind in der Lage, dieses chemische Element zu konzentrieren, was die Aktivierung von Enzymen gewährleistet, die am Prozess der Atmung und Photosynthese beteiligt sind.
Mineralien aus Mangan, insbesondere Pyrolusit, waren schon in der Antike bekannt. Pyrolusit galt als eine Art magnetisches Eisenerz und wurde beim Glasschmelzen verwendet - zur Klärung. Dass ein Mineral, anders als echtes magnetisches Eisenerz, nicht von einem Magneten angezogen wird, wurde recht amüsant erklärt: Man glaubte, Pyrolusit sei ein weibliches Mineral und einem Magneten gleichgültig.
Im 18. Jahrhundert wurde Mangan in reiner Form isoliert. Und heute werden wir ausführlich darüber sprechen. Lassen Sie uns also diskutieren, ob Mangan schädlich ist, wo Sie es kaufen können, wie man Mangan bekommt und ob es GOST entspricht.
Mangan gehört zu einer ähnlichen Periode der Gruppe 7, Gruppe 4. Das Element ist üblich - es nimmt den 14. Platz ein.
Das Element gehört zu den Schwermetallen - die Atommasse beträgt mehr als 40. Es wird an der Luft passiviert - es ist mit einem dichten Oxidfilm bedeckt, der eine weitere Reaktion mit Sauerstoff verhindert. Dank dieses Films ist es unter normalen Bedingungen inaktiv.
Beim Erhitzen reagiert Mangan mit vielen einfachen Substanzen, Säuren und Basen, und bildet Verbindungen mit sehr unterschiedlichen Oxidationsstufen: -1, -6, +2, +3, +4, +7. Das Metall gehört zu den Übergangsmetallen und zeigt daher gleichermaßen reduzierende und oxidierende Eigenschaften. Mit Metallen, zum Beispiel mit, bilden sich feste Lösungen, ohne zu reagieren.
In diesem Video erfahren Sie, was Mangan ist:
Eigenschaften und Unterschiede zu anderen Materialien
Mangan ist ein silbrig-weißes Metall, dicht, hart – mit einer ungewöhnlich komplexen Struktur. Letzteres ist die Ursache für die Zerbrechlichkeit der Substanz. Vier Modifikationen von Mangan sind bekannt. Legierungen mit Metall ermöglichen es, jedes von ihnen zu stabilisieren und feste Lösungen mit sehr unterschiedlichen Eigenschaften zu erhalten.
- Mangan ist eines der lebenswichtigen Spurenelemente. Das gilt für Pflanzen und Tiere gleichermaßen. Das Element ist an der Photosynthese beteiligt, am Atmungsprozess, aktiviert eine Reihe von Enzymen, ist ein unverzichtbarer Teilnehmer am Muskelstoffwechsel und so weiter. Die tägliche Mangandosis für den Menschen beträgt 2–9 mg. Sowohl ein Mangel als auch ein Überschuss eines Elements sind gleichermaßen gefährlich.
- Das Metall ist schwerer und härter als Eisen, hat aber aufgrund seiner hohen Sprödigkeit in reiner Form keine praktische Anwendung. Aber seine Legierungen und Verbindungen sind von ungewöhnlich großer volkswirtschaftlicher Bedeutung. Es wird in der Eisen- und Nichteisenmetallurgie, bei der Herstellung von Düngemitteln, in der Elektrotechnik, in der feinen organischen Synthese usw. verwendet.
- Mangan unterscheidet sich deutlich von den Metallen seiner eigenen Untergruppe. Technetium ist ein radioaktives Element, das künstlich gewonnen wird. Rhenium bezieht sich auf Spurenelemente und seltene Elemente. Auch Borium kann nur künstlich gewonnen werden und kommt in der Natur nicht vor. Die chemische Aktivität von Technetium und Rhenium ist viel geringer als die von Mangan. Praktische Anwendung findet, außer bei der Kernfusion, nur Mangan.
Mangan (Foto)

Vorteile und Nachteile
Die physikalischen und chemischen Eigenschaften des Metalls sind derart, dass es sich in der Praxis nicht um Mangan selbst, sondern um seine zahlreichen Verbindungen und Legierungen handelt, sodass die Vor- und Nachteile des Werkstoffs unter diesem Gesichtspunkt betrachtet werden sollten.
- Mangan bildet mit fast allen Metallen verschiedenste Legierungen, was ein klares Plus ist.
- vollständig gegenseitig löslich, das heißt, sie bilden feste Lösungen mit jedem Verhältnis des Elements, homogen in den Eigenschaften. In diesem Fall hat die Legierung einen viel niedrigeren Siedepunkt als Mangan.
- Die Legierungen des Elements mit Kohlenstoff und sind von größter praktischer Bedeutung. Beide Legierungen sind für die Stahlindustrie von großer Bedeutung.
- Zahlreiche und vielfältige Manganverbindungen werden in der Chemie-, Textil-, Glasindustrie, bei der Herstellung von Düngemitteln usw. verwendet. Grundlage dieser Vielfalt ist die chemische Aktivität der Substanz.
Die Nachteile des Metalls hängen mit den Besonderheiten seiner Struktur zusammen, die die Verwendung des Metalls selbst als Konstruktionsmaterial nicht zulassen.
- Der Hauptgrund ist die Sprödigkeit bei hoher Härte. Mn bis zu +707 C kristallisiert in einer Struktur, in der die Zelle 58 Atome umfasst.
- Ein ziemlich hoher Siedepunkt, es ist schwierig, mit Metall mit solch hohen Raten zu arbeiten.
- Die elektrische Leitfähigkeit von Mangan ist sehr gering, daher ist auch der Einsatz in der Elektrotechnik begrenzt.
Wir werden weiter über die chemischen und physikalischen Eigenschaften von Mangan sprechen.
Eigenschaften und Merkmale
Die physikalischen Eigenschaften des Metalls hängen stark von der Temperatur ab. Angesichts des Vorhandenseins von bis zu 4 Modifikationen ist dies nicht überraschend.
Die Haupteigenschaften des Stoffes sind wie folgt:
- Dichte - bei normaler Temperatur beträgt 7,45 g / cu. siehe Es ist dieser Wert, der schwach von der Temperatur abhängt: Wenn Sie beispielsweise auf 600 ° C erhitzt werden, nimmt die Dichte nur um 7% ab;
- Schmelzpunkt - 1244 ° C;
- Siedepunkt - 2095 ° C;
- die Wärmeleitfähigkeit bei 25 ° C beträgt 66,57 W / (m K), was ein niedriger Indikator für ein Metall ist;
- spezifische Wärmekapazität - 0,478 kJ / (kg·K);
- der lineare Ausdehnungskoeffizient, gemessen bei 20 C, ist gleich 22,3 · 10 -6 Grad -1 - ; Wärmekapazität und Wärmeleitfähigkeit eines Stoffes steigen linear mit steigender Temperatur;
- spezifischer elektrischer Widerstand - 1,5–2,6 μm m, nur geringfügig höher als der von Blei.
Mangan ist paramagnetisch, das heißt, es wird in einem äußeren Magnetfeld magnetisiert und von einem Magneten angezogen. Das Metall geht bei niedrigen Temperaturen in den antiferromagnetischen Zustand über, und die Übergangstemperatur für jede Modifikation ist unterschiedlich.
Die Struktur und Zusammensetzung von Mangan werden nachstehend beschrieben.
Mangan und seine Verbindungen ist das Thema des folgenden Videos:
Struktur und Zusammensetzung
Es werden vier strukturelle Modifikationen der Substanz beschrieben, die jeweils in einem bestimmten Temperaturbereich stabil sind. Fusion mit bestimmten Metallen kann jede Phase stabilisieren.
- Bis zu 707 C die a-Modifikation ist stabil. – kubisches raumzentriertes Gitter, dessen Einheitszelle 58 Atome umfasst. Eine solche Struktur ist sehr komplex und bewirkt eine hohe Zerbrechlichkeit der Substanz. Seine Indikatoren - Wärmekapazität, Wärmeleitfähigkeit, Dichte - werden als Eigenschaften eines Stoffes angegeben.
- Bei 700–1079 C stabiler ist die b-Phase mit dem gleichen Gittertyp, aber mit einer einfacheren Struktur: Die Zelle besteht aus 20 Atomen. Mangan weist in dieser Phase eine gewisse Plastizität auf. Die Dichte der b-Modifikation beträgt 7,26 g / cu. vgl. Die Phase ist leicht zu fixieren - durch Abschrecken der Substanz bei einer Temperatur oberhalb der Phasenübergangstemperatur.
- Bei Temperaturen von 1079 C bis 1143 Die g-Phase ist stabil. Es ist durch ein kubisch flächenzentriertes Gitter mit einer Zelle aus 4 Atomen gekennzeichnet. Modifikation ist plastisch. Es ist jedoch nicht möglich, die Phase beim Abkühlen vollständig zu fixieren. Bei der Übergangstemperatur beträgt die Dichte des Metalls 6,37 g/cu. cm, bei normal - 7, 21 g / cu. cm.
- Oberhalb einer Temperatur von 1143 C und zum Sieden bringen die d-Phase mit einem kubisch-raumzentrierten Gitter wird stabilisiert, dessen Zelle 2 Atome enthält. Die Modifikationsdichte beträgt 6,28 g/cu. siehe Interessanterweise kann d-Mn bei einer hohen Temperatur von 303 ° C in einen antiferromagnetischen Zustand übergehen.
Phasenübergänge sind bei der Gewinnung verschiedener Legierungen von großer Bedeutung, insbesondere da die physikalischen Eigenschaften struktureller Modifikationen unterschiedlich sind.
Die Manganproduktion wird unten beschrieben.
Produktion
 Grundsätzlich gibt es aber auch eigenständige Einlagen. So konzentrieren sich bis zu 40 % der weltweiten Reserven an Manganerzen auf dem Gebiet der Chiatura-Lagerstätte.
Grundsätzlich gibt es aber auch eigenständige Einlagen. So konzentrieren sich bis zu 40 % der weltweiten Reserven an Manganerzen auf dem Gebiet der Chiatura-Lagerstätte.
Das Element ist in fast allen Gesteinen verteilt und wird leicht ausgewaschen. Sein Gehalt im Meerwasser ist gering, aber am Grund der Ozeane bildet es zusammen mit Eisen Knötchen, in denen der Gehalt des Elements 45% erreicht. Diese Lagerstätten gelten als vielversprechend für die weitere Entwicklung.
Auf dem Territorium Russlands gibt es nur wenige große Manganvorkommen, daher ist es für die Russische Föderation ein äußerst knapper Rohstoff.
Die bekanntesten Mineralien sind Pyrolusit, Magnetit, Brownit, Manganspat und so weiter. Der Gehalt des Elements in ihnen variiert zwischen 62 und 69%. Sie werden im Steinbruch- oder Minenverfahren abgebaut. In der Regel wird das Erz vorgewaschen.
Die Gewinnung von Mangan steht in direktem Zusammenhang mit seiner Verwendung. Sein Hauptverbraucher ist die Stahlindustrie, und für ihren Bedarf wird nicht das Metall selbst benötigt, sondern seine Kombination mit Eisen - Ferromangan. Wenn es um die Herstellung von Mangan geht, meinen sie daher oft eine Verbindung, die in der Eisenmetallurgie notwendig ist.
Früher wurde Ferromangan in Hochöfen hergestellt. Aufgrund des Koksmangels und der Notwendigkeit, arme Manganerze zu verwenden, wechselten die Hersteller zum Schmelzen in Elektroöfen.
Zum Schmelzen werden mit Kohle ausgekleidete offene und geschlossene Öfen verwendet - auf diese Weise wird Kohlenstoff-Ferromangan gewonnen. Das Schmelzen erfolgt bei einer Spannung von 110-160 V mit zwei Methoden - flussmittel und flussmittelfrei. Die zweite Methode ist wirtschaftlicher, da das Element vollständiger extrahiert werden kann, jedoch ist bei einem hohen Gehalt an Kieselsäure im Erz nur die Flux-Methode möglich.
- Flussmittelfreie Methode- kontinuierlicher Prozess. Das Gemisch aus Manganerz, Koks und Eisenspänen wird beim Umschmelzen geladen. Es ist darauf zu achten, dass die Menge an Reduktionsmittel ausreichend ist. Ferromangan und Schlacke werden gleichzeitig 5–6 Mal pro Schicht produziert.
- Silicomangan hergestellt durch ein ähnliches Verfahren in einem elektrischen Schmelzofen. Die Charge enthält neben Erz auch Manganschlacke - ohne Phosphor, Quarzit und Koks.
- Metall Manganähnlich wie bei der Verhüttung von Ferromangan gewonnen. Das Rohmaterial ist Abfall vom Gießen und Schneiden der Legierung. Nach dem Schmelzen der Legierung und der Mischung wird Silikomangan zugegeben und 30 Minuten vor Ende des Schmelzens mit Druckluft ausgeblasen.
- Man erhält eine chemisch reine Substanz Elektrolyse.
Anwendung
90 % der weltweiten Manganproduktion gehen an die Stahlindustrie. Darüber hinaus müssen die meisten Metalle nicht selbst Manganlegierungen erhalten, sondern 1 % des Elements enthalten. Darüber hinaus kann es Nickel vollständig ersetzen, wenn sein Gehalt auf 4–16 % erhöht wird. Tatsache ist, dass Mangan sowohl die Austenitphase im Stahl stabilisiert.
Mangan ist ein Metall, das nicht so sehr an sich interessant ist, als vielmehr in den Eigenschaften seiner zahlreichen Verbindungen. Seine Bedeutung als Legierungselement ist jedoch kaum zu überschätzen.
Die Reaktion von Manganoxid mit Aluminium wird in diesem Video demonstriert:
DEFINITION
Mangan ist das fünfundzwanzigste Element des Periodensystems. Bezeichnung - Mn aus dem lateinischen "manganum". Befindet sich in der vierten Periode, Gruppe VIB. Bezieht sich auf Metalle. Die Grundgebühr beträgt 25.
Mangan gehört zu den ziemlich häufig vorkommenden Elementen und macht 0,1 % (Masse) der Erdkruste aus. Von den Verbindungen, die Mangan enthalten, ist Pyrolusit das häufigste Mineral, das Mangandioxid MnO 2 ist. Von großer Bedeutung sind auch die Minerale Hausmanit Mn 3 O 4 und Brownit Mn 2 O 3 .
Mangan ist als einfache Substanz ein silbrig-weißes (Abb. 1) hartes sprödes Metall. Seine Dichte beträgt 7,44 g / cm 3, Schmelzpunkt 1245 o C.
Reis. 1. Mangan. Aussehen.
Atom- und Molekulargewicht von Mangan
Relatives Molekulargewicht einer Substanz(M r) ist eine Zahl, die angibt, wie oft die Masse eines bestimmten Moleküls größer als 1/12 der Masse eines Kohlenstoffatoms ist, und relative Atommasse eines Elements(A r) - wie oft die durchschnittliche Atommasse eines chemischen Elements größer als 1/12 der Masse eines Kohlenstoffatoms ist.
Da Mangan im freien Zustand in Form von einatomigen Mn-Molekülen vorliegt, stimmen die Werte seiner atomaren und molekularen Masse überein. Sie sind gleich 54,9380.
Allotropie und allotrope Modifikationen des Mangans
Es sind vier kristalline Modifikationen von Mangan bekannt, von denen jede in einem bestimmten Temperaturbereich thermodynamisch stabil ist. Unterhalb von 707 °C ist α-Mangan stabil und hat eine komplexe Struktur – seine Elementarzelle umfasst 58 Atome. Die Komplexität der Struktur von Mangan bei Temperaturen unter 707 o Mit Ursache seiner Zerbrechlichkeit.
Isotope von Mangan
Es ist bekannt, dass Mangan in der Natur in Form des einzigen stabilen Isotops 55 Mn vorkommen kann. Die Massenzahl ist 55, der Kern eines Atoms enthält fünfundzwanzig Protonen und dreißig Neutronen.
Es gibt künstliche Manganisotope mit Massenzahlen von 44 bis 69 sowie sieben isomere Kernzustände. Das langlebigste Isotop unter den oben genannten ist 53 Mn mit einer Halbwertszeit von 3,74 Millionen Jahren.
Mangan-Ionen
Auf der äußeren Energieebene des Manganatoms gibt es sieben Valenzelektronen:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 .
Durch chemische Wechselwirkung gibt Mangan seine Valenzelektronen ab, d.h. ist ihr Spender und verwandelt sich in ein positiv geladenes Ion:
Mn 0 -2e → Mn 2+;
Mn 0 -3e → Mn 3+;
Mn 0 -4e → Mn 4+;
Mn 0 -6e → Mn 6+;
Mn 0 -7e → Mn 7+.
Molekül und Atom von Mangan
Im freien Zustand liegt Mangan in Form von einatomigen Mn-Molekülen vor. Hier sind einige Eigenschaften, die das Atom und Molekül von Mangan charakterisieren:
Manganlegierungen
Mangan wird hauptsächlich zur Herstellung von legierten Stählen verwendet. Manganstahl mit bis zu 15 % Mn hat eine hohe Härte und Festigkeit. Daraus werden Arbeitsteile von Zerkleinerungsmaschinen, Kugelmühlen, Eisenbahnschienen hergestellt. Darüber hinaus ist Mangan Bestandteil von Magnesiumbasislegierungen; es erhöht ihre Korrosionsbeständigkeit. Eine Legierung aus Kupfer mit Mangan und Nickel - Manganin hat einen niedrigen Temperaturkoeffizienten des elektrischen Widerstands. Mangan kommt in geringen Mengen in vielen Aluminiumlegierungen vor.
Beispiele für Problemlösungen
BEISPIEL 1
| Übung | Mangan wird durch Reduktion von Mangan(III)oxid mit Silizium hergestellt. Technisches Oxid mit einem Gewicht von 20 g (Massenanteil der Verunreinigungen gleich 5,2 %) wurde zu Metall reduziert. Berechnen Sie die Masse des erhaltenen Mangans. |
| Lösung | Wir schreiben die Gleichung für die Reduktion von Mangan(III)oxid mit Silizium zu Mangan: 2Mn 2 O 3 + 3Si = 3SiO 2 + 4Mn. Berechnen Sie die Masse von Mangan(III)oxid ohne Verunreinigungen: ω rein (Mn 2 O 3) \u003d 100% - ω Verunreinigung; ω rein (Mn 2 O 3) \u003d 100% - 5,2 \u003d 94,8% \u003d 0,984. m rein (Mn 2 O 3) = m Verunreinigung (Mn 2 O 3) × ω rein (Mn 2 O 3) / 100 %; m rein (Mn 2 O 3) \u003d 20 × 0,984 \u003d 19,68 g. Bestimmen wir die Menge an Mangan (III) -Oxidsubstanz (Molmasse - 158 g / mol): n (Mn 2 O 3) \u003d m (Mn 2 O 3) / M (Mn 2 O 3); n (Mn 2 O 3) \u003d 19,68 / 158 \u003d 0,12 mol. Gemäß der Reaktionsgleichung n (Mn 2 O 3) : n (Si) \u003d 2: 3, was das bedeutet n(Si) \u003d 3/2 × n (Mn 2 O 3) \u003d 3/2 × 0,12 \u003d 0,2 mol. Dann ist die Masse des Siliziums gleich (Molmasse - 28 g / mol): m (Si) = n (Si) × M (Si); m(Si) = 0,2 × 28 = 5,6 g. |
| Antworten | Masse des Siliziums 5,6 g |
BEISPIEL 2
| Übung | Berechnen Sie die Masse an Kaliumpermanganat, die erforderlich ist, um 7,9 g Kaliumsulfit in einem neutralen Medium zu oxidieren. |
| Lösung | Wir schreiben die Gleichung für die Oxidation von Kaliumsulfit mit Kaliumpermanganat in einem neutralen Medium: 2KMnO 4 + 3K 2 SO 3 + H 2 O \u003d 2MnO 2 + 3K 2 SO 4 + 2KOH. Berechnen Sie die Anzahl der Mole Kaliumsulfit (Molmasse - 158 g / mol): n (K 2 SO 3) \u003d m (K 2 SO 3) / M (K 2 SO 3); n (K 2 SO 3) \u003d 7,9 / 158 \u003d 0,05 mol. Gemäß der Reaktionsgleichung n (K 2 SO 3): n (KMnO 4) \u003d 3: 2, was das bedeutet n (KMnO 4) \u003d 2/3 × n (K 2 SO 3) \u003d 2/3 × 0,05 \u003d 0,03 mol. Die für die Oxidation von Kaliumsulfit in neutralem Medium erforderliche Masse an Kaliumpermanganat beträgt (Molmasse - 158 g / mol): m (KMnO 4) \u003d n (KMnO 4) × M (KMnO 4); m (KMnO 4) \u003d 0,03 × 158 \u003d 4,74 g. |
| Antworten | Die Masse von Kaliumpermanganat beträgt 4,74 g |
Eines der wichtigsten Metalle für die Metallurgie ist Mangan. Zudem handelt es sich generell um ein eher ungewöhnliches Element, mit dem interessante Fakten verbunden werden. Wichtig für lebende Organismen, benötigt bei der Herstellung vieler Legierungen, Chemikalien. Mangan - ein Foto davon ist unten zu sehen. Es sind seine Eigenschaften und Merkmale, die wir in diesem Artikel betrachten werden.
Eigenschaften eines chemischen Elements
Wenn wir über Mangan als Element sprechen, ist es zunächst notwendig, seine Position darin zu charakterisieren.
- Sie befindet sich in der vierten großen Periode, der siebten Gruppe, einer sekundären Untergruppe.
- Die Seriennummer ist 25. Mangan ist ein chemisches Element, dessen Atome +25 sind. Die Anzahl der Elektronen ist gleich, Neutronen - 30.
- Der Atommassenwert beträgt 54,938.
- Das Symbol für das chemische Element Mangan ist Mn.
- Der lateinische Name ist Mangan.
Es befindet sich zwischen Chrom und Eisen, was seine Ähnlichkeit mit ihnen in physikalischen und chemischen Eigenschaften erklärt.
Mangan - chemisches Element: Übergangsmetall
Wenn wir die elektronische Konfiguration eines reduzierten Atoms betrachten, sieht seine Formel so aus: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5. Es wird offensichtlich, dass das Element, das wir betrachten, aus der d-Familie stammt. Fünf Elektronen auf der 3d-Unterebene zeigen die Stabilität des Atoms an, die sich in seinen chemischen Eigenschaften manifestiert.
Als Metall ist Mangan ein Reduktionsmittel, aber die meisten seiner Verbindungen können ziemlich starke Oxidationsfähigkeiten aufweisen. Dies liegt an den unterschiedlichen Oxidationsstufen und Wertigkeiten, die dieses Element hat. Dies ist ein Merkmal aller Metalle dieser Familie.
Mangan ist also ein chemisches Element, das sich zwischen anderen Atomen befindet und seine eigenen besonderen Eigenschaften hat. Sehen wir uns diese Eigenschaften genauer an.

Mangan ist ein chemisches Element. Oxidationszustand
Wir haben bereits die elektronische Formel des Atoms angegeben. Ihr zufolge kann dieses Element mehrere positive Oxidationsstufen aufweisen. Das:
Die Wertigkeit eines Atoms ist IV. Am stabilsten sind jene Verbindungen, in denen Mangan die Werte +2, +4, +6 hat. Der höchste Oxidationsgrad lässt Verbindungen als die stärksten Oxidationsmittel wirken. Zum Beispiel: KMnO 4 , Mn 2 O 7 .
Verbindungen mit +2 sind Reduktionsmittel, Mangan(II)hydroxid hat amphotere Eigenschaften, wobei basische überwiegen. Zwischenindikatoren für Oxidationsstufen bilden amphotere Verbindungen.
Entdeckungsgeschichte
Mangan ist ein chemisches Element, das nicht sofort entdeckt wurde, sondern nach und nach und von verschiedenen Wissenschaftlern. Seine Verbindungen werden jedoch seit der Antike von Menschen verwendet. Mangan(IV)oxid wurde zum Schmelzen von Glas verwendet. Ein Italiener gab an, dass die Zugabe dieser Verbindung bei der chemischen Herstellung von Gläsern ihre Farbe lila verfärbt. Gleichzeitig hilft die gleiche Substanz, Trübungen in farbigen Gläsern zu beseitigen.
Später gelang es dem Wissenschaftler Kaim in Österreich, ein Stück metallisches Mangan zu gewinnen, indem er Pyrolysit (Mangan(IV)-oxid), Pottasche und Kohle hohen Temperaturen aussetzte. Diese Probe hatte jedoch viele Verunreinigungen, die er nicht beseitigen konnte, sodass die Entdeckung nicht stattfand.
Noch später synthetisierte ein anderer Wissenschaftler eine Mischung, in der ein erheblicher Anteil reines Metall war. Es war Bergman, der zuvor das Element Nickel entdeckt hatte. Er war jedoch nicht dazu bestimmt, die Arbeit zu beenden.

Mangan ist ein chemisches Element, das erstmals 1774 von Karl Scheele in Form einer einfachen Substanz gewonnen und isoliert wurde. Er tat dies jedoch zusammen mit I. Gan, der den Prozess des Schmelzens eines Metallstücks vollendete. Aber selbst sie schafften es nicht, es vollständig von Verunreinigungen zu befreien und eine 100%ige Produktausbeute zu erzielen.
Dennoch wurde genau zu dieser Zeit dieses Atom entdeckt. Dieselben Wissenschaftler versuchten, einen Namen wie die Entdecker zu nennen. Sie wählten den Begriff Mangan. Nach der Entdeckung von Magnesium begann jedoch Verwirrung, und der Name Mangan wurde in den modernen Namen geändert (H. David, 1908).
Da Mangan ein chemisches Element ist, dessen Eigenschaften für viele metallurgische Prozesse sehr wertvoll sind, wurde es im Laufe der Zeit notwendig, einen Weg zu finden, es in reinster Form zu gewinnen. Dieses Problem wurde von Wissenschaftlern auf der ganzen Welt gelöst, konnte aber erst 1919 dank der Arbeit des sowjetischen Chemikers R. Agladze gelöst werden. Er war es, der ein Verfahren fand, mit dem es möglich ist, aus Mangansulfaten und -chloriden durch Elektrolyse reines Metall mit einem Substanzgehalt von 99,98 % zu gewinnen. Mittlerweile wird diese Methode auf der ganzen Welt angewendet.
In der Natur sein
Mangan ist ein chemisches Element, von dem unten ein Foto einer einfachen Substanz zu sehen ist. In der Natur gibt es viele Isotope dieses Atoms, dessen Anzahl an Neutronen stark variiert. Die Massenzahlen reichen also von 44 bis 69. Das einzige stabile Isotop ist jedoch ein Element mit einem Wert von 55 Mn, alle anderen haben entweder eine vernachlässigbar kurze Halbwertszeit oder sind in zu geringen Mengen vorhanden.

Da Mangan ein chemisches Element ist, dessen Oxidationszustand sehr unterschiedlich ist, bildet es auch in der Natur viele Verbindungen. In seiner reinen Form kommt dieses Element überhaupt nicht vor. In Mineralien und Erzen ist Eisen sein ständiger Nachbar. Insgesamt lassen sich einige der wichtigsten Gesteine identifizieren, zu denen auch Mangan gehört.
- Pyrolusit. Verbindungsformel: MnO 2 * nH 2 O.
- Psilomelan, MnO2*mMnO*nH2O-Molekül.
- Manganit, Formel MnO*OH.
- Brownit ist weniger verbreitet als die anderen. Formel Mn 2 O 3.
- Gausmanit, Formel Mn*Mn 2 O 4.
- Rhodonit Mn 2 (SiO 3) 2.
- Karbonate von Mangan.
- Himbeerspat oder Rhodochrosit - MnCO 3.
- Purpurit - Mn 3 PO 4.
Darüber hinaus lassen sich noch einige weitere Minerale identifizieren, die ebenfalls das betreffende Element beinhalten. Das:
- Calcit;
- Siderit;
- Tonmineralien;
- Chalzedon;
- Opal;
- sandig-schluffige Verbindungen.
Neben Gesteinen und Sedimentgesteinen, Mineralien ist Mangan ein chemisches Element, das Bestandteil folgender Objekte ist:
- pflanzliche Organismen. Die größten Akkumulatoren dieses Elements sind: Wasserkastanie, Wasserlinse, Kieselalgen.
- Rostpilze.
- Einige Arten von Bakterien.
- Die folgenden Tiere: rote Ameisen, Krebstiere, Weichtiere.
- Menschen - der Tagesbedarf beträgt ca. 3-5 mg.
- Das Wasser der Ozeane enthält 0,3 % dieses Elements.
- Der Gesamtgehalt in der Erdkruste beträgt 0,1 Masse-%.
Im Allgemeinen ist es das 14. häufigste Element auf unserem Planeten. Unter den Schwermetallen ist es das zweitwichtigste nach Eisen.
Physikalische Eigenschaften
Aus Sicht der Eigenschaften von Mangan als einfacher Substanz können mehrere grundlegende physikalische Eigenschaften für ihn unterschieden werden.
- In Form einer einfachen Substanz ist es ein ziemlich festes Metall (auf der Mohs-Skala ist der Indikator 4). Farbe - silbrig-weiß, in der Luft mit einem schützenden Oxidfilm bedeckt, glitzert im Schnitt.
- Der Schmelzpunkt beträgt 1246 0 С.
- Sieden - 2061 0 C.
- Leitende Eigenschaften sind gut, es ist paramagnetisch.
- Die Dichte des Metalls beträgt 7,44 g/cm 3 .
- Es existiert in Form von vier polymorphen Modifikationen (α, β, γ, σ), die sich in der Struktur und Form des Kristallgitters und der Packungsdichte der Atome unterscheiden. Auch ihre Schmelzpunkte unterscheiden sich.
In der Metallurgie werden drei Hauptformen von Mangan verwendet: β, γ, σ. Alpha ist seltener, da es in seinen Eigenschaften zu zerbrechlich ist.

Chemische Eigenschaften
Chemisch gesehen ist Mangan ein chemisches Element, dessen Ionenladung stark von +2 bis +7 variiert. Dies prägt sein Wirken. In freier Form an der Luft reagiert Mangan sehr schwach mit Wasser und löst sich in verdünnten Säuren. Allerdings muss man nur die Temperatur erhöhen, da die Aktivität des Metalls stark ansteigt.
Es kann also interagieren mit:
- Stickstoff;
- Kohlenstoff;
- Halogene;
- Silizium;
- Phosphor;
- Schwefel und andere Nichtmetalle.
Beim Erhitzen ohne Luftzugang geht das Metall leicht in einen Dampfzustand über. Abhängig von der Oxidationsstufe, die Mangan aufweist, können seine Verbindungen sowohl Reduktionsmittel als auch Oxidationsmittel sein. Einige weisen amphotere Eigenschaften auf. Die wichtigsten sind also charakteristisch für Verbindungen, in denen es +2 ist. Amphoter - +4 und sauer und stark oxidierend im höchsten Wert +7.
Trotz der Tatsache, dass Mangan ein Übergangsmetall ist, gibt es nur wenige komplexe Verbindungen dafür. Dies liegt an der stabilen elektronischen Konfiguration des Atoms, denn seine 3d-Unterebene enthält 5 Elektronen.
Wie kommt man
Es gibt drei Hauptwege, auf denen Mangan (ein chemisches Element) in der Industrie gewonnen wird. Da der Name auf Latein gelesen wird, haben wir bereits - Manganum bezeichnet. Wenn Sie es ins Russische übersetzen, lautet es "Ja, ich kläre wirklich, ich verfärbe mich". Mangan verdankt seinen Namen den seit der Antike bekannten manifestierten Eigenschaften.
Trotz seiner Berühmtheit war es jedoch erst 1919 möglich, es in seiner reinen Form für den Gebrauch zu erhalten. Dies wird durch die folgenden Verfahren durchgeführt.
- Die elektrolytische Produktausbeute beträgt 99,98 %. In der chemischen Industrie wird auf diese Weise Mangan gewonnen.
- Silicothermisch oder Reduktion mit Silizium. Bei diesem Verfahren werden Silizium und Mangan(IV)oxid verschmolzen, wodurch ein reines Metall entsteht. Die Ausbeute beträgt ca. 68 %, als Nebeneffekt entsteht durch die Verbindung von Mangan mit Silizium Silizid. Dieses Verfahren wird in der metallurgischen Industrie verwendet.
- Aluminothermisches Verfahren - Restaurierung mit Aluminium. Es ergibt sich auch keine zu hohe Produktausbeute, es entsteht Mangan, das mit Verunreinigungen verunreinigt ist.
Die Herstellung dieses Metalls ist wichtig für viele Prozesse in der Metallurgie. Schon eine kleine Zugabe von Mangan kann die Eigenschaften von Legierungen stark beeinflussen. Es ist erwiesen, dass sich viele Metalle darin auflösen und sein Kristallgitter füllen.

In Bezug auf die Gewinnung und Produktion dieses Elements steht Russland weltweit an erster Stelle. Dieser Prozess wird auch in Ländern durchgeführt wie:
- China.
- Kasachstan.
- Georgia.
- Ukraine.
Industrielle Nutzung
Mangan ist ein chemisches Element, dessen Verwendung nicht nur in der Metallurgie wichtig ist. sondern auch in anderen Bereichen. Neben dem Metall in seiner reinen Form sind auch verschiedene Verbindungen dieses Atoms von großer Bedeutung. Lassen Sie uns die wichtigsten skizzieren.
- Es gibt verschiedene Arten von Legierungen, die dank Mangan einzigartige Eigenschaften haben. So ist es beispielsweise so stark und verschleißfest, dass es zum Schmelzen von Teilen für Bagger, Steinbearbeitungsmaschinen, Brecher, Kugelmühlen, Rüstungsteile verwendet wird.
- Mangandioxid ist ein obligatorisches oxidierendes Element der Galvanik, es wird zur Herstellung von Depolarisatoren verwendet.
- Viele Manganverbindungen werden für organische Synthesen verschiedener Substanzen benötigt.
- Kaliumpermanganat (oder Kaliumpermanganat) wird in der Medizin als starkes Desinfektionsmittel verwendet.
- Dieses Element ist Teil von Bronze, Messing, bildet mit Kupfer eine eigene Legierung, die zur Herstellung von Flugzeugturbinen, Schaufeln und anderen Teilen verwendet wird.
Biologische Rolle
Der tägliche Bedarf an Mangan für eine Person beträgt 3-5 mg. Ein Mangel an diesem Element führt zu einer Depression des Nervensystems, Schlafstörungen und Angstzuständen, Schwindel. Ihre Rolle ist noch nicht vollständig untersucht, aber es ist klar, dass sie vor allem Folgendes betrifft:
- Wachstum;
- Aktivität der Geschlechtsdrüsen;
- die Arbeit von Hormonen;
- Blutbildung.
Dieses Element ist in allen Pflanzen, Tieren und Menschen vorhanden, was seine wichtige biologische Rolle beweist.

Mangan ist ein chemisches Element, interessante Fakten, die jeden beeindrucken und Ihnen die Bedeutung bewusst machen können. Hier sind die grundlegendsten von ihnen, die ihre Spuren in der Geschichte dieses Metalls gefunden haben.
- In den schwierigen Zeiten des Bürgerkriegs in der UdSSR war eines der ersten Exportprodukte stark manganhaltiges Erz.
- Wenn Mangandioxid mit Salpeter legiert und das Produkt dann in Wasser gelöst wird, beginnen erstaunliche Umwandlungen. Zuerst wird die Lösung grün, dann ändert sich die Farbe zu blau, dann violett. Schließlich wird es purpurrot und ein brauner Niederschlag fällt allmählich aus. Wenn die Mischung geschüttelt wird, wird die grüne Farbe wiederhergestellt und alles wird erneut passieren. Dafür hat Kaliumpermanganat seinen Namen, was übersetzt "Mineralchamäleon" bedeutet.
- Wenn manganhaltige Düngemittel auf den Boden ausgebracht werden, steigt die Produktivität der Pflanzen und die Photosyntheserate steigt. Winterweizen bildet besser Körner.
- Der größte Block des Manganminerals Rhodonit wog 47 Tonnen und wurde im Ural gefunden.
- Es gibt eine ternäre Legierung namens Manganin. Es besteht aus Elementen wie Kupfer, Mangan und Nickel. Seine Einzigartigkeit liegt darin, dass es einen hohen elektrischen Widerstand hat, der nicht von der Temperatur abhängt, sondern vom Druck beeinflusst wird.
Das ist natürlich noch nicht alles, was man über dieses Metall sagen kann. Mangan ist ein chemisches Element, dessen interessante Fakten sehr unterschiedlich sind. Vor allem, wenn wir über die Eigenschaften sprechen, die er verschiedenen Legierungen verleiht.
Dieses Element in Form von Pyrolusit (Mangandioxid, MnO 2 ) wurde bereits vor 30.000 Jahren von prähistorischen Höhlenkünstlern in den Höhlen von Lascaux, Frankreich, verwendet. In jüngerer Zeit verwendeten Glasmacher im alten Ägypten Mineralien, die dieses Metall enthielten, um die blassgrüne Tönung von natürlichem Glas zu entfernen.
Ausgezeichnete Erze wurden in der Region Magnesia gefunden, die in Nordgriechenland südlich von Mazedonien liegt, und da begann die Verwechslung mit dem Namen. Verschiedene Erze aus der Region, die sowohl Magnesium als auch Mangan enthielten, wurden einfach als Magnesia bezeichnet. Im 17. Jahrhundert wurde der Begriff Magnesia alba oder weiße Magnesia für Magnesiummineralien übernommen, während der Name schwarze Magnesia für die dunkleren Manganoxide verwendet wurde.
Übrigens wurden die berühmten magnetischen Mineralien, die in dieser Region gefunden wurden, Magnesiastein genannt, der schließlich zum heutigen Magneten wurde. Die Verwirrung hielt noch einige Zeit an, bis Ende des 18. Jahrhunderts eine Gruppe schwedischer Chemiker zu dem Schluss kam, dass Mangan ein eigenständiges Element sei. 1774 präsentierte ein Mitglied der Gruppe diese Erkenntnisse der Stockholmer Akademie, und im selben Jahr erhielt Johan Gottlieb Hahn als erster Mensch reines Mangan und bewies es dass es sich um ein separates Element handelt.
Mangan - chemisches Element, Eigenschaften von Mangan
 Es ist ein schweres, silbrig-weißes Metall, das im Freien langsam nachdunkelt. Härter und spröder als Eisen, hat es ein spezifisches Gewicht von 7,21 und einen Schmelzpunkt von 1244 °C. Chemisches Symbol Mn, Atomgewicht 54,938, Ordnungszahl 25. In Formeln gelesen als Mangan, zum Beispiel KMnO 4 - Kaliummangan etwa vier. Dies ist ein sehr häufiges Element in Gesteinen, seine Menge wird auf 0,085 % der Masse der Erdkruste geschätzt.
Es ist ein schweres, silbrig-weißes Metall, das im Freien langsam nachdunkelt. Härter und spröder als Eisen, hat es ein spezifisches Gewicht von 7,21 und einen Schmelzpunkt von 1244 °C. Chemisches Symbol Mn, Atomgewicht 54,938, Ordnungszahl 25. In Formeln gelesen als Mangan, zum Beispiel KMnO 4 - Kaliummangan etwa vier. Dies ist ein sehr häufiges Element in Gesteinen, seine Menge wird auf 0,085 % der Masse der Erdkruste geschätzt.
Es gibt über 300 verschiedene Mineralien, die dieses Element enthält. Große terrestrische Vorkommen finden sich in Australien, Gabun, Südafrika, Brasilien und Russland. Aber noch mehr werden auf dem Meeresboden gefunden, meist in Tiefen von 4 bis 6 Kilometern, so dass der Abbau dort nicht wirtschaftlich ist.
Oxidierte Eisenminerale (Hämatit, Magnetit, Limonit und Siderit) enthalten 30 % dieses Elements. Eine weitere potenzielle Quelle sind Ton- und Rotschlammablagerungen, die bis zu 25 % Knollen enthalten. Das reinste Mangan durch Elektrolyse wässriger Lösungen gewonnen.
Mangan und Chlor befinden sich in Gruppe VII des Periodensystems, aber Chlor befindet sich in der Hauptuntergruppe und Mangan in der Nebengruppe, zu der auch Technetium Tc und Rhenium Ke gehören - vollständige elektronische Analoga. Mangan Mn, Technetium Ts und Rhenium Ke sind vollständige elektronische Analoga mit der Konfiguration von Valenzelektronen.
Dieses Element ist vorhanden in kleinen Mengen und in landwirtschaftlichen Böden. In vielen Kupfer-, Aluminium-, Magnesium- und Nickellegierungen verleihen die verschiedenen Prozentsätze ihnen spezifische physikalische und technologische Eigenschaften:
- Verschleißfestigkeit;
- Hitzeverträglichkeit;
- Korrosionsbeständigkeit;
- Schmelzbarkeit;
- elektrischer Widerstand usw.
Wertigkeiten von Mangan
Die Oxidationsstufen von Mangan liegen zwischen 0 und +7. Mangan hat in der zweiwertigen Oxidationsstufe einen ausgeprägt metallischen Charakter und eine hohe Neigung zur Bildung von Komplexbindungen. Bei der vierwertigen Oxidation überwiegt ein Zwischencharakter zwischen metallischen und nichtmetallischen Eigenschaften, während sechs- und siebenwertige nichtmetallische Eigenschaften haben.
Oxide:
Formel. Farbe

Biochemie und Pharmakologie
Mangan ist ein in der Natur weit verbreitetes Element, das in den meisten Geweben von Pflanzen und Tieren vorhanden ist. Die höchsten Konzentrationen finden sich:
- in Orangenschale;
- in Trauben;
- in Beeren;
- im Spargel;
- bei Krebstieren;
- bei Gastropoden;
- bei Doppeltüren.
Eine der wichtigsten Reaktionen in der Biologie, die Photosynthese, ist vollständig von diesem Element abhängig. Es ist der Star im Reaktionszentrum des Photosystems II, wo Wassermoleküle in Sauerstoff umgewandelt werden. Ohne sie ist Photosynthese nicht möglich..
Es ist ein essentielles Element in allen bekannten lebenden Organismen. Beispielsweise enthält das Enzym, das für die Umwandlung von Wassermolekülen in Sauerstoff während der Photosynthese verantwortlich ist, vier Manganatome.
Der durchschnittliche menschliche Körper enthält etwa 12 Milligramm dieses Metalls. Wir nehmen jeden Tag etwa 4 Milligramm aus Lebensmitteln wie Nüssen, Kleie, Müsli, Tee und Petersilie auf. Dieses Element macht die Knochen des Skeletts haltbarer. Es ist auch wichtig für die Aufnahme von Vitamin B1.
Vorteile und schädliche Eigenschaften
 Dieses Spurenelement, ist von großer biologischer Bedeutung: Es wirkt als Katalysator bei der Biosynthese von Porphyrinen und dann von Hämoglobin bei Tieren und Chlorophyll bei grünen Pflanzen. Seine Anwesenheit ist auch eine notwendige Voraussetzung für die Aktivität verschiedener mitochondrialer Enzymsysteme, einiger Fettstoffwechselenzyme und oxidativer Phosphorylierungsprozesse.
Dieses Spurenelement, ist von großer biologischer Bedeutung: Es wirkt als Katalysator bei der Biosynthese von Porphyrinen und dann von Hämoglobin bei Tieren und Chlorophyll bei grünen Pflanzen. Seine Anwesenheit ist auch eine notwendige Voraussetzung für die Aktivität verschiedener mitochondrialer Enzymsysteme, einiger Fettstoffwechselenzyme und oxidativer Phosphorylierungsprozesse.
Dämpfe oder Trinkwasser, das mit Salzen dieses Metalls kontaminiert ist, führt zu irritativen Veränderungen der Atemwege, chronischer Vergiftung mit fortschreitender und irreversibler Tendenz, gekennzeichnet durch Schädigung der Basalganglien des Zentralnervensystems und dann einer Verletzung des extrapyramidalen Typs ähnlich zur Parkinson-Krankheit.
Solche Vergiftungen sind oft professioneller Charakter. Betroffen sind Arbeiter, die in der Verarbeitung dieses Metalls und seiner Derivate beschäftigt sind, sowie Arbeiter in der chemischen und metallurgischen Industrie. In der Medizin wird es in Form von Kaliumpermanganat als adstringierendes, lokales Antiseptikum, aber auch als Gegenmittel gegen alkaloide Naturgifte (Morphin, Codein, Atropin etc.) eingesetzt.
Einige Böden haben einen geringen Gehalt an diesem Element, daher wird es Düngemitteln zugesetzt und als Nahrungsergänzung für Weidetiere gegeben.
Mangan: Anwendung
 Als reines Metall hat dieses Element mit Ausnahme einer begrenzten Verwendung im Bereich der Elektrotechnik keine anderen praktischen Anwendungen, während es gleichzeitig für die Herstellung von Legierungen, die Stahlherstellung usw. weit verbreitet ist.
Als reines Metall hat dieses Element mit Ausnahme einer begrenzten Verwendung im Bereich der Elektrotechnik keine anderen praktischen Anwendungen, während es gleichzeitig für die Herstellung von Legierungen, die Stahlherstellung usw. weit verbreitet ist.
Als Heinrich Bessemer 1856 den Prozess der Stahlherstellung erfand, wurde sein Stahl durch Warmwalzen zerstört. Das Problem wurde im selben Jahr gelöst, als entdeckt wurde, dass das Hinzufügen kleiner Mengen dieses Elements zu geschmolzenem Eisen das Problem löste. Tatsächlich werden heute etwa 90 % des gesamten Mangans für die Stahlerzeugung verwendet.