Na metalnu vezu. Neorganska hemija. Vrste metalnih kristala
Metalna veza je hemijska veza uzrokovana prisustvom relativno slobodnih elektrona. Karakteristično za čiste metale i njihove legure i intermetalne spojeve.
Mehanizam metalne veze
Pozitivni ioni metala nalaze se na svim čvorovima kristalne rešetke. Između njih, valentni elektroni se kreću nasumično, poput molekula plina, odvojenih od atoma tokom formiranja jona. Ovi elektroni djeluju kao cement, držeći pozitivne ione zajedno; inače bi se rešetka raspala pod uticajem odbojnih sila između jona. U isto vrijeme, joni drže elektrone unutar kristalne rešetke i ne mogu je napustiti. Sile spajanja nisu lokalizirane niti usmjerene.
Stoga se u većini slučajeva pojavljuju visoki koordinacijski brojevi (na primjer, 12 ili 8). Kada se dva metalna atoma približe, orbitale u njihovim vanjskim omotačima se preklapaju i formiraju molekularne orbitale. Ako se treći atom približi, njegova orbitala se preklapa s orbitalama prva dva atoma, dajući drugu molekularnu orbitalu. Kada postoji mnogo atoma, nastaje ogroman broj trodimenzionalnih molekularnih orbitala koje se protežu u svim smjerovima. Zbog višestrukog preklapanja orbitala, valentni elektroni svakog atoma su pod utjecajem mnogih atoma.
Karakteristične kristalne rešetke
Većina metala formira jednu od sljedećih visoko simetričnih rešetki sa bliskim pakiranjem atoma: kubičnu, centriranu na lice, i heksagonalnu.
U kubično-centriranoj (bcc) rešetki atomi se nalaze na vrhovima kocke, a jedan atom je u središtu volumena kocke. Metali imaju kubičnu rešetku usredsređenu na tijelo: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba, itd.
U kubičnoj (fcc) rešetki sa središtem lica, atomi se nalaze na vrhovima kocke iu centru svake površine. Metali ovog tipa imaju rešetku: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co, itd.
U heksagonalnoj rešetki atomi se nalaze na vrhovima i centru heksagonalnih osnova prizme, a tri atoma se nalaze u srednjoj ravni prizme. Metali imaju ovo pakiranje atoma: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca, itd.
Ostale nekretnine
Elektroni koji se slobodno kreću uzrokuju visoku električnu i toplotnu provodljivost. Supstance koje imaju metalnu vezu često kombinuju snagu sa plastičnošću, jer kada se atomi pomeraju jedan u odnosu na drugi, veze se ne prekidaju. Još jedno važno svojstvo je metalna aromatičnost.
Metali dobro provode toplinu i električnu energiju, dovoljno su jaki i mogu se deformirati bez razaranja. Neki metali su savitljivi (mogu se kovati), neki su savitljivi (možete izvući žicu iz njih). Ova jedinstvena svojstva objašnjavaju se posebnom vrstom hemijske veze koja povezuje atome metala jedan s drugim - metalnom vezom.
Metali u čvrstom stanju postoje u obliku kristala pozitivnih iona, kao da "plutaju" u moru elektrona koji se slobodno kreću između njih.
Metalna veza objašnjava svojstva metala, posebno njihovu snagu. Pod utjecajem sile deformacije, metalna rešetka može promijeniti svoj oblik bez pucanja, za razliku od ionskih kristala.
Visoka toplinska provodljivost metala objašnjava se činjenicom da ako se komad metala zagrije s jedne strane, kinetička energija elektrona će se povećati. Ovo povećanje energije će se velikom brzinom proširiti u "moru elektrona" kroz uzorak.
Električna provodljivost metala takođe postaje jasna. Ako se razlika potencijala primeni na krajeve metalnog uzorka, oblak delokalizovanih elektrona će se pomeriti u pravcu pozitivnog potencijala: ovaj tok elektrona koji se kreću u istom smeru predstavlja poznatu električnu struju.
Teme kodifikatora Jedinstvenog državnog ispita: Kovalentna hemijska veza, njene vrste i mehanizmi nastanka. Karakteristike kovalentnih veza (polaritet i energija veze). Jonska veza. Metalni priključak. Vodikova veza
Intramolekularne hemijske veze
Prvo, pogledajmo veze koje nastaju između čestica unutar molekula. Takve veze se nazivaju intramolekularno.
Hemijska veza između atoma hemijskih elemenata ima elektrostatičku prirodu i nastaje zbog interakcija vanjskih (valentnih) elektrona, u manjem ili većem stepenu drže pozitivno nabijena jezgra vezanih atoma.
Ključni koncept je ovdje ELEKTRONEGATIVNOST. To je ono što određuje vrstu hemijske veze između atoma i svojstva ove veze.
je sposobnost atoma da privuče (zadrži) vanjski(valencija) elektrona. Elektronegativnost je određena stepenom privlačenja spoljašnjih elektrona na jezgro i zavisi prvenstveno od radijusa atoma i naelektrisanja jezgra.
Elektronegativnost je teško jednoznačno odrediti. L. Pauling je sastavio tabelu relativnih elektronegativnosti (zasnovanu na energijama veza dvoatomskih molekula). Najelektronegativniji element je fluor sa značenjem 4 .
Važno je napomenuti da u različitim izvorima možete pronaći različite skale i tablice vrijednosti elektronegativnosti. Ovo ne treba biti uznemireno, jer formiranje hemijske veze igra ulogu atoma, a približno je isto u svakom sistemu.
Ako jedan od atoma u kemijskoj vezi A:B jače privlači elektrone, tada se elektronski par kreće prema njemu. Više razlika u elektronegativnosti atoma, što se elektronski par više pomera.
Ako su elektronegativnosti atoma u interakciji jednake ili približno jednake: EO(A)≈EO(B), tada se zajednički elektronski par ne pomiče ni na jedan od atoma: A: B. Ova veza se zove kovalentna nepolarna.
Ako se elektronegativnosti atoma u interakciji razlikuju, ali ne mnogo (razlika u elektronegativnosti je otprilike od 0,4 do 2: 0,4<ΔЭО<2 ), tada se elektronski par pomiče na jedan od atoma. Ova veza se zove kovalentna polarna .
Ako se elektronegativnosti atoma u interakciji značajno razlikuju (razlika u elektronegativnosti je veća od 2: ΔEO>2), tada se jedan od elektrona gotovo potpuno prenosi na drugi atom, sa formiranjem joni. Ova veza se zove jonski.
Osnovne vrste hemijskih veza − kovalentna, jonski I metal komunikacije. Pogledajmo ih pobliže.
Kovalentna hemijska veza
Kovalentna veza – to je hemijska veza , nastala zbog formiranje zajedničkog elektronskog para A:B . Štaviše, dva atoma preklapanje atomske orbitale. Kovalentna veza nastaje interakcijom atoma s malom razlikom u elektronegativnosti (obično između dva nemetala) ili atoma jednog elementa.
Osnovna svojstva kovalentnih veza
- fokus,
- zasićenost,
- polaritet,
- polarizabilnost.
Ova svojstva vezivanja utiču na hemijska i fizička svojstva supstanci.
Smjer komunikacije karakteriše hemijsku strukturu i oblik supstanci. Uglovi između dvije veze nazivaju se uglovi veze. Na primjer, u molekuli vode vezni ugao H-O-H je 104,45 o, stoga je molekul vode polarni, a u molekuli metana vezni ugao H-C-H je 108 o 28′.

Zasićenost je sposobnost atoma da formiraju ograničen broj kovalentnih hemijskih veza. Broj veza koji atom može formirati naziva se.
Polaritet veza nastaje zbog neravnomjerne raspodjele elektronske gustoće između dva atoma različite elektronegativnosti. Kovalentne veze dijele se na polarne i nepolarne.
Polarizabilnost veze su sposobnost veznih elektrona da se pomjeraju pod utjecajem vanjskog električnog polja(posebno, električno polje druge čestice). Polarizabilnost zavisi od pokretljivosti elektrona. Što je elektron udaljeniji od jezgre, to je pokretniji, a samim tim i molekul je više polarizabilan.

Kovalentna nepolarna hemijska veza
Postoje 2 vrste kovalentne veze - POLAR I NON-POLARNI .
Primjer . Razmotrimo strukturu molekule vodonika H2. Svaki atom vodonika na svom vanjskom energetskom nivou nosi 1 nespareni elektron. Za prikaz atoma koristimo Lewisovu strukturu - ovo je dijagram strukture vanjskog energetskog nivoa atoma, kada su elektroni označeni tačkama. Modeli Lewisove tačke strukture su od velike pomoći kada se radi sa elementima drugog perioda.
H. + . H = H:H
Dakle, molekul vodonika ima jedan zajednički elektronski par i jednu H–H hemijsku vezu. Ovaj elektronski par se ne pomera ni na jedan od atoma vodika, jer Atomi vodika imaju istu elektronegativnost. Ova veza se zove kovalentna nepolarna .

Kovalentna nepolarna (simetrična) veza je kovalentna veza koju formiraju atomi sa jednakom elektronegativnošću (obično isti nemetali) i, prema tome, sa ravnomernom raspodelom elektronske gustine između jezgara atoma.
Dipolni moment nepolarnih veza je 0.
Primjeri: H 2 (H-H), O 2 (O=O), S 8.
Kovalentna polarna hemijska veza
Kovalentna polarna veza je kovalentna veza koja se javlja između atomi različite elektronegativnosti (obično, raznih nemetala) i karakteriziran je pomak dijeli elektronski par na elektronegativniji atom (polarizacija).
Gustoća elektrona se pomjera na elektronegativniji atom - stoga se na njemu pojavljuje djelomični negativni naboj (δ-), a na manje elektronegativnom atomu pojavljuje se djelomični pozitivni naboj (δ+, delta +).
Što je veća razlika u elektronegativnosti atoma, to je veća polaritet veze i drugo dipolni moment . Između susjednih molekula i naboja suprotnog predznaka djeluju dodatne privlačne sile, koje se povećavaju snagu komunikacije.
Polaritet veze utiče na fizička i hemijska svojstva jedinjenja. Mehanizmi reakcije, pa čak i reaktivnost susjednih veza zavise od polariteta veze. Polaritet veze često određuje polaritet molekula i na taj način direktno utiče na fizička svojstva kao što su tačka ključanja i tačka topljenja, rastvorljivost u polarnim rastvaračima.
primjeri: HCl, CO 2, NH 3.
Mehanizmi stvaranja kovalentne veze
Kovalentne hemijske veze mogu nastati pomoću 2 mehanizma:
1. Mehanizam razmjene formiranje kovalentne hemijske veze je kada svaka čestica daje jedan nespareni elektron da formira zajednički elektronski par:
A . + . B= A:B
2. Formiranje kovalentne veze je mehanizam u kojem jedna od čestica daje usamljeni par elektrona, a druga čestica osigurava praznu orbitalu za ovaj elektronski par:
O: + B= A:B

U ovom slučaju, jedan od atoma daje usamljeni par elektrona ( donator), a drugi atom daje slobodnu orbitalu za taj par ( akceptor). Kao rezultat formiranja obje veze, energija elektrona se smanjuje, tj. ovo je korisno za atome.
Kovalentna veza formirana mehanizmom donor-akceptor nije drugačije u svojstvima drugih kovalentnih veza formiranih mehanizmom razmjene. Formiranje kovalentne veze mehanizmom donor-akceptor tipično je za atome ili s velikim brojem elektrona na vanjskom energetskom nivou (donori elektrona), ili, obrnuto, s vrlo malim brojem elektrona (akceptori elektrona). Valentne sposobnosti atoma su detaljnije razmotrene u odgovarajućem odjeljku.
Kovalentnu vezu formira mehanizam donor-akceptor:
- u molekulu ugljen monoksid CO(veza u molekulu je trostruka, 2 veze se formiraju mehanizmom razmene, jedna donor-akceptorskim mehanizmom): C≡O;
- V amonijum jona NH 4 +, u jonima organski amini, na primjer, u metilamonijum jonu CH 3 -NH 2 + ;
- V kompleksna jedinjenja, hemijska veza između centralnog atoma i ligandnih grupa, na primer, u natrijum tetrahidroksoaluminatu Na veza između aluminijuma i hidroksidnih jona;
- V dušične kiseline i njenih soli- nitrati: HNO 3, NaNO 3, u nekim drugim azotnim jedinjenjima;

- u molekulu ozona O3.
Osnovne karakteristike kovalentnih veza
Kovalentne veze se obično formiraju između atoma nemetala. Glavne karakteristike kovalentne veze su dužina, energija, višestrukost i usmjerenost.
Višestrukost hemijske veze
Višestrukost hemijske veze - Ovo broj zajedničkih elektronskih parova između dva atoma u spoju. Višestrukost veze može se prilično lako odrediti iz vrijednosti atoma koji formiraju molekulu.
Na primjer , u molekulu vodonika H 2 višestrukost veze je 1, jer Svaki vodonik ima samo 1 nespareni elektron na svom vanjskom energetskom nivou, stoga se formira jedan zajednički elektronski par.
U molekuli kiseonika O 2, multiplicitet veze je 2, jer Svaki atom na vanjskom energetskom nivou ima 2 nesparena elektrona: O=O.
U molekulu azota N2, multiplicitet veze je 3, jer između svakog atoma postoje 3 nesparena elektrona na vanjskom energetskom nivou, a atomi formiraju 3 zajednička elektronska para N≡N.
Dužina kovalentne veze
Dužina hemijske veze
je udaljenost između centara jezgara atoma koji formiraju vezu. Određuje se eksperimentalnim fizičkim metodama. Dužina veze može se približno procijeniti korištenjem pravila aditivnosti, prema kojem je dužina veze u molekuli AB približno jednaka polovini sume dužina veze u molekulima A 2 i B 2: 
Dužina hemijske veze može se grubo proceniti atomskim radijusima formiranje veze, ili po komunikacijskoj višestrukosti, ako radijusi atoma nisu mnogo različiti.
Kako se radijusi atoma koji formiraju vezu povećavaju, dužina veze će se povećavati.
Na primjer
Kako se povećava broj veza između atoma (čiji se atomski radijusi ne razlikuju ili se razlikuju samo malo), duljina veze će se smanjiti.
Na primjer . U nizu: C–C, C=C, C≡C, dužina veze se smanjuje.
Energija komunikacije
Mjera snage hemijske veze je energija veze. Energija komunikacije određena energijom potrebnom za prekid veze i uklanjanje atoma koji formiraju tu vezu na beskonačno veliku udaljenost jedan od drugog.
Kovalentna veza je veoma izdržljiv. Njegova energija se kreće od nekoliko desetina do nekoliko stotina kJ/mol. Što je energija veze veća, to je veća snaga veze i obrnuto.
Jačina hemijske veze zavisi od dužine veze, polariteta veze i višestrukosti veze. Što je hemijska veza duža, to je lakše prekinuti, a što je manja energija veze, to je manja njena snaga. Što je hemijska veza kraća, to je jača i veća je energija veze.
Na primjer, u nizu jedinjenja HF, HCl, HBr s leva na desno, jačina hemijske veze smanjuje se, jer Dužina veze se povećava.
Jonska hemijska veza

Jonska veza je hemijska veza zasnovana na elektrostatičko privlačenje jona.
Joni nastaju u procesu prihvatanja ili doniranja elektrona od strane atoma. Na primjer, atomi svih metala slabo drže elektrone sa vanjskog energetskog nivoa. Zbog toga se atomi metala odlikuju obnavljajuća svojstva- sposobnost doniranja elektrona.

Primjer. Atom natrijuma sadrži 1 elektron na energetskom nivou 3. Lako ga se odričući, atom natrija formira mnogo stabilniji Na + jon, sa elektronskom konfiguracijom plemenitog gasa neona Ne. Natrijum jon sadrži 11 protona i samo 10 elektrona, tako da je ukupni naboj jona -10+11 = +1:
+11N / A) 2 ) 8 ) 1 - 1e = +11 N / A +) 2 ) 8
Primjer. Atom hlora na svom vanjskom energetskom nivou sadrži 7 elektrona. Da bi stekao konfiguraciju stabilnog inertnog atoma argona Ar, klor treba da dobije 1 elektron. Nakon dodavanja elektrona, formira se stabilan jon hlora koji se sastoji od elektrona. Ukupan naboj jona je -1:
+17Cl) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Bilješka:
- Svojstva jona se razlikuju od svojstava atoma!
- Ne samo da se mogu formirati stabilni joni atomi, ali takođe grupe atoma. Na primjer: amonijum jon NH 4 +, sulfatni jon SO 4 2-, itd. Hemijske veze formirane od takvih jona takođe se smatraju jonskim;
- Jonske veze se obično formiraju jedna između druge metali I nemetali(nemetalne grupe);
Nastali ioni se privlače zbog električne privlačnosti: Na + Cl -, Na 2 + SO 4 2-.
Hajde da vizuelno sumiramo razlika između tipa kovalentne i jonske veze:


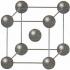
Metalni priključak je veza koja se formira relativno slobodnih elektrona između metalni joni, formirajući kristalnu rešetku.
Atomi metala se obično nalaze na vanjskom energetskom nivou jedan do tri elektrona. Radijusi atoma metala su, u pravilu, veliki - dakle, atomi metala, za razliku od nemetala, prilično lako odustaju od svojih vanjskih elektrona, tj. su jaki redukcioni agensi.
Doniranjem elektrona, atomi metala se pretvaraju u pozitivno nabijenih jona . Odvojeni elektroni su relativno slobodni se kreću između pozitivno nabijenih metalnih jona. Između ovih čestica nastaje veza, jer zajednički elektroni drže metalne katjone raspoređene u slojeve zajedno , čime se stvara prilično jaka metalna kristalna rešetka . U ovom slučaju, elektroni se neprekidno kreću haotično, tj. Neprestano se pojavljuju novi neutralni atomi i novi kationi.

Intermolekularne interakcije
Zasebno, vrijedno je razmotriti interakcije koje nastaju između pojedinačnih molekula u tvari - intermolekularne interakcije . Intermolekularne interakcije su vrsta interakcije između neutralnih atoma u kojoj se ne pojavljuju nove kovalentne veze. Sile interakcije između molekula otkrio je Van der Waals 1869. godine i dobio ime po njemu. Van dar Waalsove snage. Van der Waalsove snage se dijele na orijentacija, indukcija I disperzivno . Energija međumolekularnih interakcija je mnogo manja od energije hemijskih veza.
Orijentacijske sile privlačenja nastaju između polarnih molekula (dipol-dipol interakcija). Ove sile se javljaju između polarnih molekula. Induktivne interakcije je interakcija između polarnog i nepolarnog molekula. Nepolarna molekula je polarizirana zbog djelovanja polarnog, što stvara dodatnu elektrostatičku privlačnost.
Posebna vrsta međumolekularne interakcije su vodikove veze. - to su intermolekularne (ili intramolekularne) hemijske veze koje nastaju između molekula koje imaju visoko polarne kovalentne veze - H-F, H-O ili H-N. Ako postoje takve veze u molekulu, onda će ih postojati između molekula dodatne privlačne sile .
Obrazovni mehanizam vodonična veza je dijelom elektrostatička, a dijelom donorsko-akceptorna. U ovom slučaju, donor elektronskog para je atom jako elektronegativnog elementa (F, O, N), a akceptor su atomi vodika povezani sa ovim atomima. Vodikove veze karakteriziraju fokus u svemiru i saturation
Vodikove veze mogu se označiti tačkama: H ··· O. Što je veća elektronegativnost atoma spojenog na vodonik, i što je manja njegova veličina, to je jača vodikova veza. Tipičan je prvenstveno za veze fluor sa vodonikom , kao i do kiseonik i vodonik , manje azot sa vodonikom .

Vodikove veze nastaju između sljedećih supstanci:
— fluorovodonik HF(gas, rastvor fluorovodonika u vodi - fluorovodonična kiselina), vode H 2 O (para, led, tečna voda):
— rastvor amonijaka i organskih amina- između molekula amonijaka i vode;
— organska jedinjenja u kojima se vezuju O-H ili N-H: alkoholi, karboksilne kiseline, amini, aminokiseline, fenoli, anilin i njegovi derivati, proteini, rastvori ugljenih hidrata - monosaharidi i disaharidi.
Vodikova veza utiče na fizička i hemijska svojstva supstanci. Dakle, dodatno privlačenje između molekula otežava ključanje tvari. Supstance sa vodoničnim vezama pokazuju abnormalno povećanje tačke ključanja.
Na primjer U pravilu, s povećanjem molekularne težine, uočava se povećanje točke ključanja tvari. Međutim, u nizu supstanci H 2 O-H 2 S-H 2 Se-H 2 Te ne uočavamo linearnu promjenu u tačkama ključanja.

Naime, kod tačka ključanja vode je nenormalno visoka - ne manje od -61 o C, kako nam pokazuje prava linija, ali mnogo više, +100 o C. Ova anomalija se objašnjava prisustvom vodoničnih veza između molekula vode. Dakle, u normalnim uslovima (0-20 o C) voda je tečnost po faznom stanju.
Metalna veza je veza nastala između atoma u uslovima jake delokalizacije (distribucija valentnih elektrona preko nekoliko hemijskih veza u jedinjenju) i nedostatka elektrona u atomu (kristal). Nezasićena je i prostorno neusmjerena.
Delokalizacija valentnih elektrona u metalima je posljedica multicentrične prirode metalne veze. Višecentrična priroda metalne veze osigurava visoku električnu provodljivost i toplotnu provodljivost metala.
Zasićenost određena brojem valentnih orbitala uključenih u formiranje hemikalije. komunikacije. Kvantitativna karakteristika – valencija. Valencija je broj veza koje jedan atom može formirati s drugima; - određuje se brojem valentnih orbitala uključenih u formiranje veza prema razmjenskim i donor-akceptorskim mehanizmima.
Focus – veza se formira u pravcu maksimalnog preklapanja elektronskih oblaka; - određuje hemijsku i kristalno hemijsku strukturu supstance (kako su atomi povezani u kristalnu rešetku).
Kada se formira kovalentna veza, gustina elektrona je koncentrisana između atoma u interakciji (crtanje iz sveske). U slučaju metalne veze, elektronska gustina je delokalizovana kroz kristal. (crtanje iz sveske)
(primjer iz notebooka)
Zbog nezasićene i neusmjerene prirode metalne veze, metalna tijela (kristali) su visoko simetrična i visoko koordinirana. Velika većina metalnih kristalnih struktura odgovara 3 tipa atomskog pakovanja u kristalima:
1. GCC– zrnasto centrirana kubična zbijena struktura. Gustina pakovanja – 74,05%, koordinacioni broj = 12.
2. GPU– heksagonalna zbijena struktura, gustina pakovanja = 74,05%, c.h. = 12.
3. BCC– zapremina je centrirana, gustina pakovanja = 68,1%, c.h. = 8.
Metalna veza ne isključuje određeni stepen kovalentnosti. Metalno vezivanje u svom čistom obliku karakteristično je samo za alkalne i zemnoalkalne metale.
Čistu metalnu vezu karakteriše energija reda 100/150/200 kJ/mol, 4 puta slabija od kovalentne.
36. Hlor i njegova svojstva. V=1(III, IV, V i VII) oksidaciono stanje=7, 6, 5, 4, 3, 1, −1
žuto-zeleni gas sa oštrim iritirajućim mirisom. Klor se u prirodi javlja samo u obliku jedinjenja. U prirodi u obliku kalijum hlorida, magnezijuma, nitrijuma, nastalih kao rezultat isparavanja nekadašnjih mora i jezera. Receipt.prom:2NaCl+2H2O=2NaOH+H2+Cl2, elektrolizom vode hlorida Me.\2KMnO4+16HCl=2MnCl2+2KCl+8H2O+5Cl2/Hemijski, hlor je veoma aktivan, direktno se kombinuje sa skoro svim Me, a sa ne- metali (osim ugljenika, azota, kiseonika, inertnih gasova), zamenjuje vodonik u ugljovodonicima i spaja nezasićena jedinjenja, istiskuje brom i jod iz njihovih jedinjenja, fosfor se pali u atmosferi hlora PCl3, a daljim hlorisanjem - PCl5; sumpor sa hlorom = S2Sl2, SSl2 i drugi SnClm. Mešavina hlora i vodonika sagoreva sa kiseonikom, hlor stvara okside: Cl2O, ClO2, Cl2O6, Cl2O7, Cl2O8, kao i hipohlorite (soli hipohlorne kiseline), hlorite, hlorate i perhlorate. Sva kiseonikova jedinjenja hlora tvore eksplozivne mešavine sa lako oksidativnim supstancama. Oksidi hlora su nestabilni i mogu spontano da eksplodiraju. u vodi - hipohlorna i slana: Cl2 + H2O = HClO + HCl. Prilikom hlorisanja vodenih rastvora lužina na hladnom nastaju hipohloriti i hloridi: 2NaOH + Cl2 = NaClO + NaCl + H2O, a pri zagrevanju nastaju hlorati. Kada amonijak reaguje s hlorom, nastaje dušikov triklorid. interhalogenih spojeva sa drugim halogenima. Fluoridi ClF, ClF3, ClF5 su vrlo reaktivni; na primjer, u atmosferi ClF3, staklena vuna se spontano zapali. Poznata jedinjenja hlora sa kiseonikom i fluorom su hlor oksifluoridi: ClO3F, ClO2F3, ClOF, ClOF3 i fluor perhlorat FClO4. primjena: proizvodnja hemijskih jedinjenja, prečišćavanje vode, sinteza hrane, farmaceutska industrija, baktericid, antiseptik, beljenje papira, tkanina, pirotehnika, šibice, uništava korov u poljoprivredi.
Biološka uloga: biogeni, komponenta biljnih i životinjskih tkiva. 100g je glavna osmotski aktivna supstanca u krvnoj plazmi, limfi, likvoru i nekim tkivima Dnevna potreba za natrijum hloridom = 6-9g - hleb, meso i mlečni proizvodi. Igra ulogu u metabolizmu vode i soli, potičući zadržavanje vode u tkivima. Regulacija kiselinsko-bazne ravnoteže u tkivima odvija se zajedno s drugim procesima promjenom distribucije hlora između krvi i drugih tkiva. Klor ima pozitivan učinak na apsorpciju kisika korijenjem, komponentom željeznog soka.
37. Vodonik, B = 1-1; Ion vodika je potpuno lišen elektronskih ljuski i može se približiti vrlo bliskim udaljenostima i prodrijeti u elektronske ljuske.
Najčešći element u svemiru. On čini glavninu Sunca, zvijezda i drugih kosmičkih tijela U slobodnom stanju na Zemlji, nalazi se relativno rijetko - nalazi se u nafti i zapaljivim plinovima, prisutan je u obliku inkluzija u nekim mineralima i većini. to u vodi. Prijem: 1. Laboratorija Zn+2HCl=ZnCl2+H2 ; 2.Si+2NaOH+H 2 O=Na 2 SiO 3 +2H 2; 3. Al+NaOH+H 2 O=Na(AlOH) 4 +H 2. 4. U industriji: konverzija, elektroliza: SH4+H2O=CO+3H2\CO+H2O=CO+ H2/Him St. U br.:H 2 +F 2 =2HF. Kada su ozračeni, osvijetljeni, katalizatori: H 2 + O 2 , S, N, P = H 2 O, H 2 S, NH 3 , Ca + H2 = CaH2\F2 + H2 = 2HF\N2 + 3H2 → 2NH3\Cl2 + H2 → 2HCl, 2NO+2H2=N2+2H2O,CuO+H2=Cu+H2O,CO+H2=CH3OH. Vodik formira hidride: jonske, kovalentne i metalne. Do jonskog –NaH -& ,CaH 2 -& +H 2 O=Ca(OH) 2 ;NaH+H 2 O=NaOH+H 2 . Kovalentni –B 2 H 6 , AlH 3 , SiH 4 . Metal – sa d-elementima; varijabilni sastav: MeH ≤1, MeH ≤2 – uvode se u praznine između atoma. Provodi toplotu, struju, čvrste materije. WATER.sp3-hibridna visoko polarna molekula pod uglom od 104,5 , dipoli, najčešći rastvarač Voda na sobnoj temperaturi reaguje sa aktivnim halogenima (F, Cl) i interhalogenim spojevima sa solima, slabim oblicima i slabim bazama, uzrokujući njihovu potpunu hidrolizu. sa ugljičnim i anorganskim anhidridima i kiselim halogenidima. kiselina; sa spojevima aktivnih metalnih organa; sa karbidima, nitridima, fosfidima, silicidima, hidridima aktivnog Me; sa mnogim solima, tvoreći hidrate s boranima, s ketenima, ugljičnim dioksidom sa fluoridima; Voda reaguje kada se zagreje: sa Fe, Mg, ugljem, metanom sa nekim alkil halogenidima. Primjena: vodonik -sinteza amonijaka, metanola, hlorovodonika, TV masti, vodikovog plamena - za zavarivanje, topljenje, u metalurgiji za redukciju Me iz oksida, gorivo za rakete, u farmaciji - voda, peroksid-antiseptik, baktericid, pranje, izbjeljivanje kose , sterilizacija.
Biološka uloga: vodonik-7kg, Glavna funkcija vodika je strukturiranje biološkog prostora (voda i vodikove veze) i formiranje raznih organskih molekula (uključenih u strukturu proteina, ugljikohidrata, masti, enzima) Zahvaljujući vodikovim vezama,
kopiranje molekula DNK. Voda učestvuje u ogromnom
broj biohemijskih reakcija, u svim fiziološkim i biološkim
procesa, osigurava metabolizam između tijela i vanjske sredine, između
ćelije i unutar ćelija. Voda je strukturna osnova ćelija i neophodna je za
održavajući njihov optimalni volumen, određuje prostornu strukturu i
funkcije biomolekula.
Atomi većine elemenata ne postoje odvojeno, jer mogu međusobno komunicirati. Ova interakcija proizvodi složenije čestice.
Priroda kemijske veze je djelovanje elektrostatičkih sila, koje su sile interakcije između električnih naboja. Takav naboj imaju elektroni i atomska jezgra.
Elektroni koji se nalaze na spoljnim elektronskim nivoima (valentni elektroni), koji su najudaljeniji od jezgra, najslabije su u interakciji s njim, pa su stoga u stanju da se odvoje od jezgra. Oni su odgovorni za međusobno povezivanje atoma.
Vrste interakcija u hemiji
Vrste hemijskih veza mogu se predstaviti u sljedećoj tabeli:
Karakteristike jonske veze
 Hemijska reakcija koja se javlja zbog jonska privlačnost koji imaju različite naboje naziva se jonski. To se događa ako atomi koji se vezuju imaju značajnu razliku u elektronegativnosti (to jest, sposobnost privlačenja elektrona) i elektronski par ide na elektronegativniji element. Rezultat ovog prijenosa elektrona s jednog atoma na drugi je formiranje nabijenih čestica - jona. Među njima se javlja privlačnost.
Hemijska reakcija koja se javlja zbog jonska privlačnost koji imaju različite naboje naziva se jonski. To se događa ako atomi koji se vezuju imaju značajnu razliku u elektronegativnosti (to jest, sposobnost privlačenja elektrona) i elektronski par ide na elektronegativniji element. Rezultat ovog prijenosa elektrona s jednog atoma na drugi je formiranje nabijenih čestica - jona. Među njima se javlja privlačnost.
Imaju najniže indekse elektronegativnosti tipični metali, a najveći su tipični nemetali. Ioni se tako formiraju interakcijom između tipičnih metala i tipičnih nemetala.
Atomi metala postaju pozitivno nabijeni joni (kationi), donirajući elektrone svojim vanjskim nivoima elektrona, a nemetali prihvataju elektrone, pretvarajući se u negativno naelektrisan joni (anjoni).
Atomi prelaze u stabilnije energetsko stanje, dovršavajući svoje elektronske konfiguracije.
Jonska veza je neusmjerena i nezasićena, budući da se elektrostatička interakcija događa u svim smjerovima, ion može privući ione suprotnog predznaka u svim smjerovima.
Raspored jona je takav da se oko svakog nalazi određeni broj suprotno nabijenih jona. Koncept "molekula" za jonska jedinjenja nema smisla.
Primjeri obrazovanja
 Formiranje veze u natrijevom kloridu (nacl) nastaje zbog prijenosa elektrona s atoma Na na atom Cl kako bi se formirali odgovarajući ioni:
Formiranje veze u natrijevom kloridu (nacl) nastaje zbog prijenosa elektrona s atoma Na na atom Cl kako bi se formirali odgovarajući ioni:
Na 0 - 1 e = Na + (kation)
Cl 0 + 1 e = Cl - (anion)
U natrijum hloridu postoji šest hloridnih anjona oko kationa natrijuma i šest natrijumovih jona oko svakog hloridnog jona.
Kada se formira interakcija između atoma u barijum sulfidu, dešavaju se sledeći procesi:
Ba 0 - 2 e = Ba 2+
S 0 + 2 e = S 2-
Ba donira svoja dva elektrona sumporu, što rezultira stvaranjem sumpornih anjona S 2- i barijevih kationa Ba 2+.
Metalna hemijska veza
 Broj elektrona u vanjskim energetskim nivoima metala je mali; Kao rezultat ovog odvajanja nastaju metalni joni i slobodni elektroni. Ovi elektroni se nazivaju "elektronski gas". Elektroni se slobodno kreću po volumenu metala i stalno su vezani i odvojeni od atoma.
Broj elektrona u vanjskim energetskim nivoima metala je mali; Kao rezultat ovog odvajanja nastaju metalni joni i slobodni elektroni. Ovi elektroni se nazivaju "elektronski gas". Elektroni se slobodno kreću po volumenu metala i stalno su vezani i odvojeni od atoma.
Struktura metalne supstance je sljedeća: kristalna rešetka je kostur tvari, a između njenih čvorova elektroni se mogu slobodno kretati.
Mogu se navesti sljedeći primjeri:
Mg - 2e<->Mg 2+
Cs-e<->Cs+
Ca - 2e<->Ca2+
Fe-3e<->Fe 3+
Kovalentni: polarni i nepolarni
 Najčešći tip hemijske interakcije je kovalentna veza. Vrijednosti elektronegativnosti elemenata koji su u interakciji se ne razlikuju oštro, stoga se javlja samo pomak zajedničkog elektronskog para na elektronegativniji atom.
Najčešći tip hemijske interakcije je kovalentna veza. Vrijednosti elektronegativnosti elemenata koji su u interakciji se ne razlikuju oštro, stoga se javlja samo pomak zajedničkog elektronskog para na elektronegativniji atom.
Kovalentne interakcije se mogu formirati mehanizmom razmjene ili mehanizmom donor-akceptor.
Mehanizam razmjene se ostvaruje ako svaki od atoma ima nesparene elektrone na vanjskim elektronskim nivoima i preklapanje atomskih orbitala dovodi do pojave para elektrona koji već pripada oba atoma. Kada jedan od atoma ima par elektrona na vanjskom elektronskom nivou, a drugi ima slobodnu orbitalu, onda kada se atomske orbitale preklapaju, elektronski par se dijeli i djeluje u skladu s mehanizmom donor-akceptor.
Kovalentne se po višestrukosti dijele na:
- jednostavan ili pojedinačni;
- duplo;
- trostruke.
Dvostruki osiguravaju dijeljenje dva para elektrona odjednom, a trostruki - tri.
Prema raspodjeli elektronske gustine (polariteta) između povezanih atoma, kovalentna veza se dijeli na:
- nepolarni;
- polar.
Nepolarnu vezu formiraju identični atomi, a polarnu vezu je različita elektronegativnost.
 Interakcija atoma slične elektronegativnosti naziva se nepolarna veza. Zajednički par elektrona u takvoj molekuli ne privlači nijedan atom, već podjednako pripada oba.
Interakcija atoma slične elektronegativnosti naziva se nepolarna veza. Zajednički par elektrona u takvoj molekuli ne privlači nijedan atom, već podjednako pripada oba.
Interakcija elemenata koji se razlikuju po elektronegativnosti dovodi do stvaranja polarnih veza. U ovoj vrsti interakcije, zajednički parovi elektrona privlače se elektronegativnijim elementom, ali se ne prenose u potpunosti na njega (odnosno, ne dolazi do stvaranja jona). Kao rezultat ovog pomaka u gustini elektrona, na atomima se pojavljuju parcijalni naboji: elektronegativniji imaju negativan naboj, a manje elektronegativni imaju pozitivan naboj.
Svojstva i karakteristike kovalentnosti
Glavne karakteristike kovalentne veze:
- Dužina je određena rastojanjem između jezgara atoma u interakciji.
- Polaritet je određen pomakom elektronskog oblaka prema jednom od atoma.
- Usmjerenost je svojstvo formiranja veza orijentiranih u prostoru i, shodno tome, molekula određenih geometrijskih oblika.
- Zasićenost je određena sposobnošću formiranja ograničenog broja veza.
- Polarizabilnost je određena sposobnošću promjene polariteta pod utjecajem vanjskog električnog polja.
- Energija potrebna za prekid veze određuje njenu snagu.
 Primer kovalentne nepolarne interakcije mogu biti molekuli vodonika (H2), hlora (Cl2), kiseonika (O2), azota (N2) i mnogi drugi.
Primer kovalentne nepolarne interakcije mogu biti molekuli vodonika (H2), hlora (Cl2), kiseonika (O2), azota (N2) i mnogi drugi.
H· + ·H → H-H molekula ima jednu nepolarnu vezu,
O: + :O → O=O molekula ima dvostruki nepolarni,
Ṅ: + Ṅ: → N≡N molekul je trostruko nepolaran.
Primjeri kovalentnih veza kemijskih elemenata uključuju molekule ugljičnog dioksida (CO2) i ugljičnog monoksida (CO), sumporovodika (H2S), hlorovodonične kiseline (HCL), vode (H2O), metana (CH4), sumpornog oksida (SO2) i mnogi drugi.
U molekuli CO2, odnos između atoma ugljika i kisika je kovalentno polarni, budući da elektronegativniji vodik privlači gustinu elektrona. Kiseonik ima dva nesparena elektrona u svojoj spoljašnjoj ljusci, dok ugljenik može da obezbedi četiri valentna elektrona za formiranje interakcije. Kao rezultat, nastaju dvostruke veze i molekul izgleda ovako: O=C=O.
Da bi se odredio tip veze u određenom molekulu, dovoljno je razmotriti njegove sastavne atome. Jednostavne metalne supstance formiraju metalnu vezu, metali sa nemetalima formiraju ionsku vezu, jednostavne nemetalne supstance formiraju kovalentnu nepolarnu vezu, a molekule koje se sastoje od različitih nemetala formiraju kroz polarnu kovalentnu vezu.
Klasifikacija materijala
Trenutno su svi savremeni materijali klasifikovani prema tome.
Najvažnije u tehnologiji su klasifikacije prema funkcionalno i strukturno karakteristike materijala.
Glavni kriterij za klasifikaciju materijala prema strukturnim karakteristikama je agregatno stanje, u zavisnosti od čega se dele na sledeće vrste: čvrsti materijali, tečnosti, gasovi, plazma.
Čvrsti materijali se, pak, dijele na kristalne i nekristalne.
Kristalni materijali se mogu podijeliti prema vrsti veze između čestica: atomski (kovalentni), jonski, metalni, molekularni (slika 2.1.).
Vrste veza između atoma (molekula) u kristalima
Atom se sastoji od pozitivno nabijenog jezgra i elektrona (negativno nabijenih) koji se kreću oko njega. Atom u stacionarnom stanju je električno neutralan. Postoje eksterni (valentni) elektroni, čija je veza sa jezgrom beznačajna, i unutrašnji elektroni, koji su čvrsto povezani sa jezgrom.
Formiranje kristalne rešetke odvija se na sljedeći način. Tokom prijelaza iz tekućeg u kristalno stanje, udaljenost između atoma se smanjuje, a sile interakcije između njih se povećavaju.
Veza između atoma se vrši elektrostatičkim silama, tj. Po prirodi, veza je ista - električna je po prirodi, ali se različito manifestira u različitim kristalima. Razlikuju se sljedeće vrste veza: ionske, kovalentne, polarne, metalne.
Tip kovalentne veze
Kovalentna veza nastaje zbog zajedničkih elektronskih parova koji se pojavljuju u omotaču povezanih atoma.
Možda je ona formiran od atoma istog elementa i tada je nepolaran; na primjer, takva kovalentna veza postoji u molekulima jednoelementnih plinova H 2, O 2, N 2, Cl 2 itd.
Kovalentna veza može biti formirana od atoma različitih elemenata, sličnih po hemijskom karakteru, i tada je polarna; na primjer, takva kovalentna veza postoji u molekulima H 2 O, NF 3, CO 2.
Kovalentna veza se formira između atoma elemenata koji su po prirodi elektronegativni.
Sa ovom vrstom veze dijele se slobodni valentni elektroni susjednih atoma. U nastojanju da steknu stabilnu valentnu ljusku koja se sastoji od 8 elektrona, atomi se spajaju u molekule, formirajući jedan ili više parova elektrona, koji postaju zajednički za spojne atome, tj. istovremeno čine dio elektronskih omotača dva atoma.
Materijali sa kovalentnom vezom su vrlo krti, ali imaju visoku tvrdoću (dijamant). To su, po pravilu, dielektrici ili poluprovodnici (germanijum, silicijum) jer električni naboji su međusobno povezani i nema slobodnih elektrona.
Atomi u molekulima jednostavnih gasova (H 2, Cl 2 itd.) povezani su kovalentnim vezama.
Jedina supstanca poznata čovjeku s primjerom kovalentne veze između metala i ugljika je cijanokobalamin, poznat kao vitamin B12.
 jonski vezani kristali (NaCl)
jonski vezani kristali (NaCl)
Jonska veza je hemijska veza obrazovan zahvaljujući elektrostatička privlačnost između kationa I anjoni.
Formiranje takvih kristala nastaje prijelazom elektrona atoma jedne vrste u atome druge vrste iz Na u Cl. Atom koji izgubi elektron postaje pozitivno nabijen ion, dok atom koji dobije elektron postaje negativni ion. Konvergencija jona različitih predznaka događa se sve dok odbojne sile jezgra i elektronske ljuske ne uravnoteže sile privlačenja. Većina mineralnih dielektrika i neki organski materijali imaju jonske veze (NaCl, CsCl, CaF2.)
Čvrste tvari s ionskim vezama su u većini slučajeva mehanički jake i otporne na temperaturu, ali često krte. Materijali sa ovom vrstom veze ne koriste se kao konstrukcijski materijali.
Metalni tip priključka
U metalima, veza između pojedinačnih atoma nastaje zbog interakcije pozitivno nabijenih jezgara i kolektiviziranih elektrona, koji se slobodno kreću u međuatomskim prostorima. Ovi elektroni djeluju kao cement, držeći pozitivne ione zajedno; inače bi se rešetka raspala pod uticajem odbojnih sila između jona. U isto vrijeme, joni drže elektrone unutar kristalne rešetke i ne mogu je napustiti. Ova veza se naziva metalna.
Prisustvo slobodnih elektrona dovodi do visoke električne i toplotne provodljivosti metala, a ujedno je i razlog za sjaj metala. Savitljivost metala se objašnjava kretanjem i klizanjem pojedinih slojeva atoma.
U gotovo svakom materijalu ne postoji jedna, već nekoliko vrsta veza. Svojstva materijala određuju preovlađujući tipovi hemijskih veza atoma i molekula supstance materijala.
Od atomsko-kristalnih materijala čijom strukturom dominiraju kovalentne veze, polimorfne modifikacije ugljeničnih i poluprovodničkih materijala zasnovane na elementima IV grupe periodnog sistema su od najvećeg značaja u tehnici. Tipični predstavnici prvih su dijamant i grafit - najčešća i stabilna modifikacija ugljika sa slojevitom strukturom u zemljinoj kori. Poluprovodnički kristalni germanijum i silicijum su glavni materijali poluprovodničke elektronike.
Od velikog interesa su neka jedinjenja sa kovalentnim vezama, kao što su Fe 3 C, SiO, AlN - ova jedinjenja igraju važnu ulogu u tehničkim legurama.
U ogromnu totalitet jonski kristal materijali koji imaju kristalnu strukturu sa jonskim tipom veze uključuju okside metala (spojine metala sa kiseonikom), koji su sastavni deo najvažnijih ruda, tehnološke dodatke za topljenje metala, kao i hemijske spojeve metala i nemetala ( bor, ugljenik, azot), koji se koriste kao komponente legure.
Metalni tip veze karakterističan je za više od 80 elemenata periodnog sistema.
TO kristalne čvrste materije mogu se uključiti i materijali sa strukturom molekularni kristali, što je karakteristično za mnoge polimerne materijale čiji se molekuli sastoje od velikog broja ponavljajućih jedinica. To su biopolimeri - visokomolekularna prirodna jedinjenja i njihovi derivati (uključujući drvo); sintetički polimeri dobiveni od jednostavnih organskih spojeva, čije molekule imaju neorganske glavne lance i ne sadrže organske bočne grupe. Neorganski polimeri uključuju silikate i veziva. Prirodni silikati su klasa najvažnijih minerala za stvaranje stijena, koji čine oko 80% mase zemljine kore. Neorganski vezivni materijali uključuju cement, gips, kreč, itd. Molekularni kristali inertnih gasova - elementi grupe VIII periodnog sistema - isparavaju na niskim temperaturama bez prelaska u tečno stanje. Primenu nalaze u krioelektronici, koja se bavi stvaranjem elektronskih uređaja zasnovanih na pojavama koje se javljaju u čvrstim materijama na kriogenim temperaturama.

Rice. 1.2. Raspored atoma u kristalnoj (a) i amorfnoj (b) materiji
Druga klasa materijala se sastoji nekristalnih čvrstih materijala. Na osnovu reda i stabilnosti strukture dijele se na amorfne, staklaste i nestaklaste u poluporemećenom stanju.
Tipični predstavnici amorfnih materijala su amorfni poluvodiči, amorfni metali i legure.
Za grupu staklast materijali uključuju: niz organskih polimera (polimetilakrilat na temperaturama ispod 105°C, polivinil hlorid - ispod 82°C i drugi); mnogi neorganski materijali - anorgansko staklo na bazi oksida silicijuma, bora, aluminijuma, fosfora itd.; mnogi materijali za livenje kamena - bazalti i dijabazi staklaste strukture, metalurške troske, prirodni karbonati ostrvske i lančane strukture (dolomit, lapor, mermer itd.).
U nestaklenom, poluporemećenom stanju su želei (strukturirani sistemi polimer-otapalo nastali tokom skrućivanja polimernih rastvora ili bubrenja čvrstih polimera), mnogi sintetički polimeri u visokoelastičnom stanju, gume, većina materijala na bazi biopolimera , uključujući tekstilne i kožne materijale, kao i organske vezivne materijale - bitumen, katran, smole itd.
Po funkcionalnoj namjeni tehnički materijali su podijeljeni u sljedeće grupe.
Građevinski materijali - čvrsti materijali namijenjeni za proizvodnju proizvoda koji su podložni mehaničkom naprezanju. Moraju imati skup mehaničkih svojstava koja osiguravaju potrebne performanse i vijek trajanja proizvoda kada su izloženi radnom okruženju, temperaturi i drugim faktorima.
Rice. 1.1. Klasifikacija čvrstih kristalnih materijala prema strukturnim karakteristikama
Istovremeno, oni su podložni tehnološkim zahtjevima koji određuju najmanje radno intenzivnu proizvodnju dijelova i konstrukcija, te ekonomskim u pogledu cijene i dostupnosti materijala, što je vrlo važno u uvjetima masovne proizvodnje. Strukturni materijali uključuju metale, silikate i keramiku, polimere, gumu, drvo i mnoge kompozitne materijale.
Električni materijali odlikuju se posebnim električnim i magnetskim svojstvima i namijenjeni su za proizvodnju proizvoda koji se koriste za proizvodnju, prijenos, konverziju i potrošnju električne energije. To uključuje magnetne materijale, provodnike, poluvodiče, kao i dielektrike u čvrstoj tečnoj i gasovitoj fazi.
Tribotehnički materijali namijenjeni su za upotrebu u jedinicama za trenje kako bi se regulirali parametri trenja i habanja kako bi se osigurale specificirane performanse i vijek trajanja ovih jedinica. Glavne vrste takvih materijala su mazivi, antifrikcioni i frikcioni materijali. Prvi uključuju maziva u čvrstoj (grafit, talk, molibden disulfid, itd.), tečnoj (ulja za podmazivanje) i gasovitim fazama (vazduh, pare ugljovodonika i drugi gasovi). babbit, bronza i dr.), sivi liv, plastika (tekstolit, materijali na bazi fluoroplasta i dr.), metalokeramički kompozitni materijali (bronza-grafit, gvožđe-grafit itd.), neke vrste drveta i drvo- laminirana plastika, guma, mnogi kompoziti imaju visok koeficijent trenja i visoku otpornost na habanje. Tu spadaju neke vrste plastike, liveno gvožđe, kermet i drugi kompozitni materijali.
Materijali za alat Odlikuju se visokim nivoom tvrdoće, otpornosti na habanje i čvrstoće, namijenjeni su za izradu reznih, mjernih, vodovodnih i drugih alata. To uključuje materijale kao što su alatni čelik i tvrde legure, dijamant i neke vrste keramičkih materijala, te mnoge kompozitne materijale.
Radni fluidi - gasoviti i tečni materijali uz pomoć kojih se energija pretvara u mehanički rad, hladnoću i toplotu. Radni fluidi su vodena para u parnim mašinama i turbinama; amonijak, ugljični dioksid, freon i druga rashladna sredstva u rashladnim mašinama; hidraulična ulja; zrak u zračnim motorima; gasoviti produkti sagorevanja organskog goriva u gasnim turbinama i motorima sa unutrašnjim sagorevanjem.
Gorivo - zapaljivi materijali, čiji je glavni dio ugljik, koji se koriste za proizvodnju toplinske energije pri sagorijevanju. Goriva se prema porijeklu dijele na prirodna (nafta, ugalj, prirodni plin, uljni škriljci, treset, drvo) i umjetna (koks, motorna goriva, generatorski plinovi itd.); prema vrsti mašine u kojoj se spaljuje - raketni, motorni, nuklearni, turbinski itd.