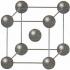
Na металлическая связь. Неорганическая химия. Типы кристаллов металлов
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Механизм металлической связи
Во всех узлах кристаллической решётки расположены положительные ионы металла . Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены.
Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8). Когда два атома металла сближаются, орбитали их внешних оболочек перекрываются, образуя молекулярные орбитали. Если подходит третий атом, его орбиталь перекрывается с орбиталями первых двух атомов, что дает еще одну молекулярную орбиталь. Когда атомов много, возникает огромное число трехмерных молекулярных орбиталей, простирающихся во всех направлениях. Вследствие многократного перекрывания орбиталей валентные электроны каждого атома испытывают влияние многих атомов.
Характерные кристаллические решётки
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt,Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей. Также важным свойством является металлическая ароматичность.
Металлы хорошо проводят тепло и электричество, они достаточно прочны, их можно деформировать без разрушения. Некоторые металлы ковкие (их можно ковать), некоторые тягучие (из них можно вытягивать проволоку). Эти уникальные свойства объясняются особым типом химической связи, соединяющей атомы металлов между собой - металлической связью.
Металлы в твердом состоянии существуют в виде кристаллов из положительных ионов, как бы “плавающих” в море свободно движущихся между ними электронов.
Металлическая связь объясняет свойства металлов, в частности, их прочность. Под действием деформирующей силы решетка металла может изменять свою форму, не давая трещин, в отличие от ионных кристаллов.
Высокая теплопроводность металлов объясняется тем, что если нагреть кусок металла с одной стороны, то кинетическая энергия электронов увеличится. Это увеличение энергии распространится в “ электронном море” по всему образцу с большой скоростью.
Становится понятной и электрическая проводимость металлов. Если к концам металлического образца приложить разность потенциалов, то облако делокализованных электронов будет сдвигаться в направлении положительного потенциала: этот поток электронов, движущихся в одном направлении, и представляет собой всем знакомый электрический ток.
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Внутримолекулярные химические связи
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными .
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов , в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Ключевое понятие здесь – ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ . Именно она определяет тип химической связи между атомами и свойства этой связи.
– это способность атома притягивать (удерживать) внешние (валентные) электроны . Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Электроотрицательность сложно определить однозначно. Л.Полинг составил таблицу относительных электроотрицательностей (на основе энергий связей двухатомных молекул). Наиболее электроотрицательный элемент – фтор со значением 4 .
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Если значения электроотрицательностей взаимодействующих атомов равны или примерно равны: ЭО(А)≈ЭО(В) , то общая электронная пара не смещается ни к одному из атомов: А: В . Такая связь называется ковалентной неполярной.
Если электроотрицательности взаимодействующих атомов отличаются, но не сильно (разница электроотрицательностей примерно от 0,4 до 2: 0,4<ΔЭО<2 ), то электронная пара смещается к одному из атомов. Такая связь называется ковалентная полярная .
Если электроотрицательности взаимодействующих атомов отличаются существенно (разница электроотрицательностей больше 2: ΔЭО>2 ), то один из электронов практически полностью переходит к другому атому, с образованием ионов . Такая связь называется ионная .
Основные типы химических связей — ковалентная , ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Ковалентная связь – этохимическая связь, образованная за счет образования общей электронной пары А:В . При этом у двух атомов перекрываются атомные орбитали. Ковалентная связь образуется при взаимодействии атомов с небольшой разницей электроотрицательностей (как правило, между двумя неметаллами ) или атомов одного элемента.
Основные свойства ковалентных связей
- направленность ,
- насыщаемость ,
- полярность ,
- поляризуемость .
Эти свойства связи влияют на химические и физические свойства веществ.
Направленность связи характеризует химическое строение и форму веществ. Углы между двумя связями называются валентными. Например, в молекуле воды валентный угол H-O-H равен 104,45 о, поэтому молекула воды — полярная, а в молекуле метана валентный угол Н-С-Н 108 о 28′.

Насыщаемость — это спосбность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется .
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.

Ковалентная неполярная химическая связь
Существует 2 вида ковалентного связывания – ПОЛЯРНЫЙ и НЕПОЛЯРНЫЙ .
Пример . Рассмотрим строение молекулы водорода H 2 . Каждый атом водорода на внешнем энергетическом уровне несет 1 неспаренный электрон. Для отображения атома используем структуру Льюиса – это схема строения внешнего энергетического уровня атома, когда электроны обозначаются точками. Модели точечных структур Люьиса неплохо помогают при работе с элементами второго периода.
H . + . H = H:H
Таким образом, в молекуле водорода одна общая электронная пара и одна химическая связь H–H. Эта электронная пара не смещается ни к одному из атомов водорода, т.к. электроотрицательность у атомов водорода одинаковая. Такая связь называется ковалентной неполярной .

Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Примеры : H 2 (H-H), O 2 (O=O), S 8 .
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами ) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Чем больше различие в электроотрицательностях атомов, тем выше полярность связи и тем больше дипольный момент . Между соседними молекулами и противоположными по знаку зарядами действуют дополнительные силы притяжения, что увеличивает прочность связи.
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Примеры: HCl, CO 2 , NH 3 .
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
А . + . В= А:В
2. образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В

При этом один из атомов предоставляет неподеленную электронную пару (донор ), а другой атом предоставляет вакантную орбиталь для этой пары (акцептор ). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей .
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в ионе аммония NH 4 + , в ионах органических аминов , например, в ионе метиламмония CH 3 -NH 2 + ;
– в комплексных соединениях , химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO 3 , NaNO 3 , в некоторых других соединениях азота;

– в молекуле озона O 3 .
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении . Кратность связи достаточно легко можно определить из значения атомов, образующих молекулу.
Например , в молекуле водорода H 2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O 2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N 2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи
– это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А 2 и В 2:
Длину химической связи можно примерно оценить по радиусам атомов , образующих связь, или по кратности связи , если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
Например
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Например . В ряду: C–C, C=C, C≡C длина связи уменьшается.
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Например , в ряду соединений HF, HCl, HBr слева направо прочность химической связи уменьшается , т.к. увеличивается длина связи.
Ионная химическая связь

Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов .
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.

Пример . Атом натрия содержит на 3 энергетическом уровне 1 электрон. Легко отдавая его, атом натрия образует гораздо более устойчивый ион Na + , с электронной конфигурацией благородного газа неона Ne. В ионе натрия содержится 11 протонов и только 10 электронов, поэтому суммарный заряд иона -10+11 = +1:
+11Na ) 2 ) 8 ) 1 — 1e = +11Na +) 2 ) 8
Пример . Атом хлора на внешнем энергетическом уровне содержит 7 электронов. Чтобы приобрести конфигурацию стабильного инертного атома аргона Ar, хлору необходимо присоединить 1 электрон. После присоединения электрона образуется стабильный ион хлора, состоящий из электронов. Суммарный заряд иона равен -1:
+17Cl ) 2 ) 8 ) 7 + 1e = +17Cl — ) 2 ) 8 ) 8
Обратите внимание:
- Свойства ионов отличаются от свойств атомов!
- Устойчивые ионы могут образовывать не только атомы , но и группы атомов . Например: ион аммония NH 4 + , сульфат-ион SO 4 2- и др. Химические связи, образованные такими ионами, также считаются ионными;
- Ионную связь, как правило, образуют между собой металлы и неметаллы (группы неметаллов);
Образовавшиеся ионы притягиваются за счет электрического притяжения: Na + Cl — , Na 2 + SO 4 2- .
Наглядно обобщим различие между ковалентными и ионным типами связи :


Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов , образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов . Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями .
Отдавая электроны, атомы металлов превращаются в положительно заряженные ионы . Оторвавшиеся электроны относительно свободно перемещаются между положительно заряженными ионами металлов. Между этими частицами возникает связь , т.к. общие электроны удерживают катионы металлов, расположенные слоями, вместе , создавая таким образом достаточно прочную металлическую кристаллическую решетку . При этом электроны непрерывно хаотично двигаются, т.е. постоянно возникают новые нейтральные атомы и новые катионы.

Межмолекулярные взаимо-действия
Отдельно стоит рассмотреть взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия . Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не появляеются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами . Силы Ван-дер-Ваальса делятся на ориентационные , индукционные и дисперсионные . Энергия межмолекулярных взаимодейстий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи. — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N . Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения .
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость .
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь . Она характерна прежде всего для соединений фтора с водородом , а также кислорода с водородом , в меньшей степени азота с водородом .

Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H 2 O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H : спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Например , как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H 2 O-H 2 S-H 2 Se-H 2 Te мы не наблюдаем линейное изменение температур кипения.

А именно, у воды температура кипения аномально высокая — не меньше -61 о С, как показывает нам прямая линия, а намного больше, +100 о С. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20 о С) вода является жидкостью по фазовому состоянию.
Металлическая связь – это связь, образованная между атомами в условиях сильновыраженной делокализации (распространение валентных электронов по нескольким химическим связям в соединении) и дефицита электронов в атоме (кристалле). Является ненасыщенной и пространственно ненаправленной.
Делокализация валентных электронов в металлах является следствием многоцентрового характера металлической связи. Многоцентровость металлической связи обеспечивает высокую электрическую проводимость и теплопроводность металлов.
Насыщаемость определяется числом валентных орбиталей, участвующих в образовании хим. связи. Количественная характеристика – валентность. Валентность – число связей, которые может образовывать один атом с другими; - определяется числом валентных орбиталей, участвующих в образовании связи по обменному и донорно-акцепторному механизму.
Направленность – связь образуется в направлении максимального перекрывания электронных облаков; - определяет химическое и кристаллохимическое строение вещества (как связаны атомы в кристаллической решетке).
При образовании ковалентной связи электронная плотность концентрируется между взаимодействующими атомами (рисунок из тетради) . В случае металлической связи электронная плотность делокализована по всему кристаллу.(рисунок из тетради)
(пример из тетради)
По причине ненасыщенности и ненаправленности металлической связи, металлические тела (кристаллы) являются высоко симметричными и высоко координированными. Подавляющему большинству кристаллических структур металла отвечают 3 типа упаковок атома в кристаллах:
1. ГЦК – гренецентрированна кубическая плотноупокованная структура. Плотность упаковки – 74,05%, координационное число = 12.
2. ГПУ – гексогональная плотноупакованная структура, плотность упаковки = 74,05%, к.ч. = 12.
3. ОЦК – объем центрируется, плотность упаковки = 68,1%, к.ч. = 8.
Металлическая связь не исключает некоторой доли ковалентности. Металлическая связь в чистом виде характерна только для щелочных и щелочно-земельных металлов.
Чистая металлическая связь характеризуется энергией порядка 100/150/200 кДж/моль, в 4 раза слабее ковалентной.
36. Хлор и его свойства. В=1(III, IV, V и VII)степ.окисления=7, 6, 5, 4, 3, 1, −1
жёлто-зелёный газ с резким раздражающим запахом. Xлор встречается в природе только в виде соединений. В природе в виде хлоридова калия,магния,нитрия,образовавшихся в рез-те испарения бывших морей,озёр. Получение.пром :2NaCl+2H2O=2NaOH+H2+Cl2,электролизом вод р-ов хлоридовMe.\2KMnO4+16HCl=2MnCl2+2KCl+8H2O+5Cl2/Химически хлор очень активен, непосред¬ственно соединяется почти со всеми Ме, и с неметаллами (кроме углерода, азота, кислорода, инертных газов),замещает водород в пред УВ и присоединяется к ненасыщенным соединениям,вытесняет бром и иод из их соединений.Фосфор воспламеняется в атмосфере хлора РСl3, а при дальнейшем хлорировании - РСl5; сера с хлором = S2Сl2, SСl2 и другие SnClm. Смесь хлора с водородом горит.С кислородом хлор образует окислы: Cl2O, ClO2, Cl2O6, Cl2O7, Cl2O8, а также гипохлориты (соли хлорноватистой кислоты), хлориты, хлораты и перхлораты. Все кислородные соединения хлора образуют взрывоопасные смеси с легко окисляющимися веществами. Окислы хлора малостойки и могут самопроизвольно взрываться, гипохлориты при хранении медленно разлагаются, хлораты и перхлораты могут взрываться под влиянием инициаторов. в воде -хлорноватистую и сол: Сl2 + Н2О = НСlО + НСl. При хлорировании водных растворов щелочей на холоду образуются гипохлориты и хлориды: 2NаОН + Сl2 = NаСlO + NаСl + Н2О, а при нагревании - хлораты. При взаимодействии аммиака с хлором образуется трёххлористый азот. с другими галогенами межгалогенные соединения. Фториды СlF, СlF3, СlF5 очень реакционноспособны; например, в атмосфере СlF3 стеклянная вата самовоспламеняется. Известны соединения хлора с кислородом к фтором - оксифториды хлора: СlО3F, СlО2F3, СlOF, СlОF3 и перхлорат фтора FСlO4.Применение: производство хим.соед,очистка воды,синтезы в пищевой,фарм пром-ти-бактерицид,антисепт.,отбеливание бумаг,тканей,пиротехника,спички,в СХ уничтожает сорняки.
Биологическая роль: биогенный, компонент тканей растений и животных. 100г основное осмотически активное вещество плазмы крови, лимфы, спинномозговой жидкости и некоторых тканей.Сут потребн хлористого натрия =6-9г-хлеб, мясные и молочные продукты. Играет роль в водно-солевом обмене, способствуя удержанию тканями воды. Регуляция кислотно-щелочного равновесия в тканях осуществляется наряду с другими процессами путём изменения в распределении хлора между кровью и другими тканями, хлор участвует в энергетическом обмене у растений, активируя как окислительное фосфорилирование, так и фотофосфорилирование. Xлор положительно влияет на поглощение корнями кислорода,компонент жел.сока.
37. Водород, вода.В=1;ст.окисл=+1-1 Водород ион полностью лишен электронных оболочек, может подходить на очень близкие расстояния, внедряться в электронные оболочки.
Самый распространенный элемент Вселенной. Он составляет основную массу Солнца, звезд и других космических тел.В свободном состоянии на Земле он встречается сравнительно редко - содержится в нефтяных и горючих газах, присутствует в виде включений в некоторых минералах,больш.часть в составе воды.Получение: 1. Лаборатория Zn+2HCl=ZnCl2+H 2 ; 2.Si+2NaOH+H 2 O=Na 2 SiO 3 +2H 2 ; 3. Al+NaOH+H 2 O=Na(AlOH) 4 +H 2 . 4. В промышленности: конверсия, электролиз:СH4+H2O=CO+3H2\CO+H2O=CO+H 2/Хим св-ва. В н.у.:H 2 +F 2 =2HF. При облучении, освещении, катализаторы:H 2 +O 2 ,S,N,P=H 2 O,H 2 S,NH 3 , Ca + Н2 = СаН2\F2 + H2 = 2HF\N2 + 3H2 → 2NH3\Cl2 + H2 → 2HCl, 2NO+2H2=N2+2H2O,CuO+H2=Cu+H2O,CO+H2=CH3OH. Водород образует гидриды: ионные, ковалентные и металлические. К ионным –NaH -& ,CaH 2 -& +H 2 O=Ca(OH) 2 ;NaH+H 2 O=NaOH+H 2 . Ковалентные –B 2 H 6 ,AlH 3 ,SiH 4 . Металлические –сd-элементами; состав переменный:MeH ≤1 ,MeH ≤2 – внедряются в пустоты между атомами.Проводит тепло, ток, твердые.ВОДА.сп3-гибридная сильнополярн.молекула под углом 104,5 ,диполи,наиб.распростран.растворитель.Вода реаг-ет при комнатной t:с активными мес галогенами (F, Cl) и межгалоидными соед-ямис солями, образов-ми слабой к-той и слабым осн-ем, вызывая их полный гидролиз; с ангидридами и галогенангидридами карбоновых и неорганич. кис-т; с активными металлорган-ми соед-ми; с карбидами, нитридами, фосфидами, силицидами, гидридами активных Mе; со многими солями, образуя гидраты;с боранами, силанами;с кетенами, недоокисью углерода;с фторидами благородных газов. Вода реаг-ет при нагревании: с Fe, Mgс углем, метаном;с некот алкилгалогенидами.Применение:водород -синтез аммиака,метанола,хлороводорода,ТВ.жиров,пламя водорода-для сварки,плавления,в металлургии для восстановления Ме из оксида,топливо для ракет,в фармации-вода,пероксид-антисепт,бактерицид,промывание,обесцвечивание волос,стерилизация.
Биол.роль: водород-7кг, Основная функция водорода– структурирование биологического пространства(вода и водородные связи) и формирование разнообразия орг молекул(входит в структуру белков, углеводов, жиров, ферментов) Благодаря водородным связям осуществляется
копирование молекулы ДНК. Вода принимает участие в громадном
количестве биохимических реакций, во всех физиологических и биологических
процессах, обеспечивает обмен веществ между организмом и внешней средой, между
клетками и внутри клеток. Вода является структурной основой клеток, необходима для
поддержания ими оптимального объема, она определяет пространственную структуру и
функции биомолекул.
Атомы большинства элементов не существуют отдельно, так как могут взаимодействовать между собой. При этом взаимодействии образуются более сложные частицы.
Природа химической связи состоит в действии электростатических сил, которые являются силами взаимодействия между электрическими зарядами. Такие заряды имеют электроны и ядра атомов.
Электроны, расположенные на внешних электронных уровнях (валентные электроны) находясь дальше всех от ядра, слабее всего с ним взаимодействуют, а значит способны отрываться от ядра. Именно они отвечают за связывание атомов друг с другом.
Типы взаимодействия в химии
Типы химической связи можно представить в виде следующей таблицы:
Характеристика ионной связи
 Химическое взаимодействие, которое образуется из-за притяжения ионов
, имеющих разные заряды, называется ионным. Такое происходит, если связываемые атомы имеют существенную разницу в электроотрицательности (то есть способности притягивать электроны) и электронная пара переходит к более электроотрицательному элементу. Результатом такого перехода электронов от одного атома к другому является образование заряженных частиц - ионов. Между ними и возникает притяжение.
Химическое взаимодействие, которое образуется из-за притяжения ионов
, имеющих разные заряды, называется ионным. Такое происходит, если связываемые атомы имеют существенную разницу в электроотрицательности (то есть способности притягивать электроны) и электронная пара переходит к более электроотрицательному элементу. Результатом такого перехода электронов от одного атома к другому является образование заряженных частиц - ионов. Между ними и возникает притяжение.
Наименьшими показателями электроотрицательности обладают типичные металлы , а наибольшими - типичные неметаллы. Ионы, таким образом, образуются при взаимодействии между типичными металлами и типичными неметаллами.
Атомы металла становятся положительно заряженными ионами (катионами), отдавая электроны внешних электронных уровней, а неметаллы принимают электроны, превращаясь таким образом в отрицательно заряженные ионы (анионы).
Атомы переходят в более устойчивое энергетическое состояние, завершая свои электронные конфигурации.
Ионная связь ненаправленная и не насыщаемая, так как электростатическое взаимодействие происходит во все стороны, соответственно ион может притягивать ионы противоположного знака во всех направлениях.
Расположение ионов таково, что вокруг каждого находится определённое число противоположно заряженных ионов. Понятие «молекула» для ионных соединений смысла не имеет .
Примеры образования
 Образование связи в хлориде натрия (nacl) обусловлено передачей электрона от атома Na к атому Cl с образованием соответствующих ионов:
Образование связи в хлориде натрия (nacl) обусловлено передачей электрона от атома Na к атому Cl с образованием соответствующих ионов:
Na 0 - 1 е = Na + (катион)
Cl 0 + 1 е = Cl — (анион)
В хлориде натрия вокруг катионов натрия расположено шесть анионов хлора, а вокруг каждого иона хлора — шесть ионов натрия.
При образовании взаимодействия между атомами в сульфиде бария происходят следующие процессы:
Ba 0 - 2 е = Ba 2+
S 0 + 2 е = S 2-
Ва отдаёт свои два электрона сере в результате чего образуются анионы серы S 2- и катионы бария Ba 2+ .
Металлическая химическая связь
 Число электронов внешних энергетических уровней металлов невелико, они легко отрываются от ядра. В результате такого отрыва образуются ионы металла и свободные электроны. Эти электроны называются «электронным газом». Электроны свободно перемещаются по объёму металла и постоянно связываются и отрываются от атомов.
Число электронов внешних энергетических уровней металлов невелико, они легко отрываются от ядра. В результате такого отрыва образуются ионы металла и свободные электроны. Эти электроны называются «электронным газом». Электроны свободно перемещаются по объёму металла и постоянно связываются и отрываются от атомов.
Строение вещества металла таково: кристаллическая решётка является остовом вещества, а между её узлами электроны могут свободно перемещаться.
Можно привести следующие примеры:
Mg - 2е <-> Mg 2+
Cs - e <-> Cs +
Ca - 2e <-> Ca 2+
Fe - 3e <-> Fe 3+
Ковалентная: полярная и неполярная
 Наиболее распространённым видом химического взаимодействия является ковалентная связь. Значения электроотрицательности элементов, вступающих во взаимодействие, отличаются не резко, в связи с этим происходит только смещение общей электронной пары к более электроотрицательному атому.
Наиболее распространённым видом химического взаимодействия является ковалентная связь. Значения электроотрицательности элементов, вступающих во взаимодействие, отличаются не резко, в связи с этим происходит только смещение общей электронной пары к более электроотрицательному атому.
Ковалентное взаимодействие может образовываться по обменному механизму или по донорно-акцепторному.
Обменный механизм реализуется, если у каждого из атомов есть неспаренные электроны на внешних электронных уровнях и перекрывание атомных орбиталей приводит к возникновению пары электронов, принадлежащей уже обоим атомам. Когда же у одного из атомов есть пара электронов на внешнем электронном уровне, а у другого — свободная орбиталь, то при перекрывании атомных орбиталей происходит обобществление электронной пары и взаимодействие по донорно-акцепторному механизму.
Ковалентные разделяются по кратности на:
- простые или одинарные;
- двойные;
- тройные.
Двойные обеспечивают обобществление сразу двух пар электронов, а тройные — трёх.
По распределению электронной плотности (полярности) между связываемыми атомами ковалентная связь делится на:
- неполярную;
- полярную.
Неполярную связь образуют одинаковые атомы, а полярную - разные по электроотрицательности.
 Взаимодействие близких по электроотрицательности атомов называют неполярной связью. Общая пара электронов в такой молекуле не притянута ни к одному из атомов, а принадлежит в равной мере обоим.
Взаимодействие близких по электроотрицательности атомов называют неполярной связью. Общая пара электронов в такой молекуле не притянута ни к одному из атомов, а принадлежит в равной мере обоим.
Взаимодействие различающихся по электроотрицательности элементов приводит к образованию полярных связей. Общие электронные пары при таком типе взаимодействия притягиваются более электроотрицательным элементом, но полностью к нему не переходят (то есть образования ионов не происходит). В результате такого смещения электронной плотности на атомах появляются частичные заряды: на более электроотрицательном — отрицательный заряд, а на менее — положительный.
Свойства и характеристика ковалентности
Основные характеристики ковалентной связи:
- Длина определяется расстоянием между ядрами взаимодействующих атомов.
- Полярность определяется смещением электронного облака к одному из атомов.
- Направленность - свойство образовывать ориентированные в пространстве связи и, соответственно, молекулы, имеющие определённые геометрические формы.
- Насыщаемость определяется способностью образовывать ограниченное число связей.
- Поляризуемость определяется способностью изменять полярность под действием внешнего электрического поля.
- Энергия необходимая для разрушения связи, определяющая её прочность.
 Примером ковалентного неполярного взаимодействия могут быть молекулы водорода (H2) , хлора (Cl2), кислорода (O2), азота (N2) и многие другие.
Примером ковалентного неполярного взаимодействия могут быть молекулы водорода (H2) , хлора (Cl2), кислорода (O2), азота (N2) и многие другие.
H· + ·H → H-H молекула имеет одинарную неполярную связь,
O: + :O → O=O молекула имеет двойную неполярную,
Ṅ: + Ṅ: → N≡N молекула имеет тройную неполярную.
В качестве примеров ковалентной связи химических элементов можно привести молекулы углекислого (CO2) и угарного (CO) газа, сероводорода (H2S), соляной кислоты (HCL), воды (H2O), метана (CH4) , оксида серы (SO2) и многих других.
В молекуле CO2 взаимосвязь между углеродом и атомами кислорода ковалентная полярная, так как более электроотрицательный водород притягивает к себе электронную плотность. Кислород имеет два неспаренных электрона на внешнем уровне, а углерод может предоставить для образования взаимодействия четыре валентных электрона. В результате образуются двойные связи и молекула выглядит так: O=C=O.
Для того чтобы определиться с типом связи в той или иной молекуле, достаточно рассмотреть составляющие её атомы. Простые вещества металлы образуют металлическую, металлы с неметаллами — ионную, простые вещества неметаллы — ковалентную неполярную, а молекулы, состоящие из разных неметаллов, образуются посредством ковалентной полярной связью.
Классификация материалов
В настоящее время все современные материалы принято соответствующим образом классифицировать.
Наибольшее значение в технике имеют классификации по функциональным и структурным признакам материалов.
Главным критерием классификации материалов по структурным признакам является агрегатное состояние, в зависимости от которого их подразделяют на следующие типы: твердые материалы, жидкости, газы, плазма.
Твердые материалы в свою очередь делят на кристаллические и некристаллические.
Кристаллические материалы можно разделить по типу связи между частицами: атомные (ковалентные), ионные, металлические, молекулярные (Рис.2.1.).
Типы связей между атомами (молекулами) в кристаллах
Атом состоит из положительно заряженного ядра и движущихся вокруг него электронов (отрицательно заряженных). Атом в стационарном состоянии электрически нейтрален. Различают внешние (валентные) электроны, связь которых с ядром незначительна и внутренние – прочно связанные с ядром.
Формирование кристаллической решетки происходит следующим образом. При переходе из жидкого в кристаллическое состояние расстояние между атомами сокращается, а силы взаимодействия между ними возрастают.
Связь между атомами осуществляется электростатическими силами, т.е. по природе связь едина – имеет электрическую природу, но проявляется по-разному в разных кристаллах. Различают следующие типы связей: ионную, ковалентную, полярную, металлическую.
Ковалентный вид связи
Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов.
Она может быть образована атомами одного итого же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H 2 , O 2 , N 2 , Cl 2 и др.
Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах H 2 O, NF 3 , CO 2 .
Ковалентная связь образуется между атомами элементов, обладающих электроотрицательным характером.
При этом типе связи осуществляется обобществление свободных валентных электронов соседних атомов. Стремясь приобрести устойчивую валентную оболочку, состоящую из 8 электронов, атомы объединяются в молекулы, образуя одну или несколько пар электронов, которые становятся общими для соединяющихся атомов, т.е. одновременно входят в состав электронных оболочек двух атомов.
Материалы с ковалентной связью очень хрупки, но имеют высокую твердость (алмаз). Это, как правило, диэлектрики или полупроводники (германий, кремни) т.к. электрические заряды связаны между собой, а свободные электроны отсутствуют.
Ковалентной связью соединены атомы в молекулах простых газов (Н 2 , Cl 2 и др.)
Единственным известным человеку веществом с примером ковалентной связи между металлом и углеродом является цианокобаламин, известный как витамин B12.
 Кристаллы с ионной связью (NaCl)
Кристаллы с ионной связью (NaCl)
Ионная связь - это химическая связь, образованная за счет электростатического притяжения между катионами и анионами .
Образование таких кристаллов образуется переходом электронов атомов одного типа к атомам другого от Na к Cl. Атом, потерявший электрон, становится положительно заряженным ионом, присоединивший электрон – отрицательным ионом. Сближение ионов разных знаков происходит до тех пор пока силы отталкивания ядра и электронных оболочек не уравновесят силы притяжения. Ионную связь имеют большинство минеральных диэлектриков и некоторые органические материалы.(NaCl, CsCl, CaF2.)
Твердые тела с ионной связью в большинстве случаев механически прочны, температуростойчивы, но часто хрупки. Материалы с этим типом связи в качестве конструкционных не применяются
Металлический тип связи
В металлах связь между отдельными атомами образуется за счет взаимодействия положительно заряженных ядер и коллективизированных электронов, которые свободно движутся в межатомных пространствах. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Такая связь называется металлической.
Наличие свободных электронов приводит к высокой электропроводности и теплопроводности металла, а также является причиной блеска металлов. Ковкость металлов объясняется перемещением и скольжением отдельных слоев атомов.
Практически в любом материале имеет место не один, а несколько типов связей. Свойства же материалов определяются преобладающими видами химических связей атомов и молекул вещества материала.
Из атомно-кристаллических материалов, в структуре которых преобладают ковалентные связи , наибольшее значение в технике имеют полиморфные модификации углерода и полупроводниковые материалы на основе элементов IV группы периодической системы элементов. Типичными представителями первых являются алмаз и графит - наиболее распространенная в земной коре и устойчивая модификация углерода со слоистой структурой. Полупроводниковые кристаллические германий и кремний являются основными материалами полупроводниковой электроники.
Большой интерес представляют некоторые соединения с ковалентной связью, такие как Fe 3 C, SiO, AlN - эти соединения играют большую роль в технических сплавах.
В обширную совокупность ионно-кристаллических материалов, имеющих кристаллическую структуру с ионным типом связей, входят оксиды металлов (соединения металлов с кислородом), которые являются составляющими важнейших руд, технологических присадок при плавке металлов, а также химические соединения металлов и неметаллов (бором, углеродом, азотом), которые используются как компоненты сплавов.
Металлический тип связи характерен для более чем 80 элементов таблицы Менделеева.
К кристаллическим твердым телам можно отнести и материалы со структурой молекулярных кристаллов , которая характерна для многих полимерных материалов, молекулы которых состоят из большого числа повторяющихся звеньев. Это биополимеры - высокомолекулярные природные соединения и их производные (в том числе древесина); синтетические полимеры, получаемые из простых органических соединений, молекулы которых имеют неорганические главные цепи и не содержат органических боковых групп. К числу неорганических полимеров относят силикаты и вяжущие. Природные силикаты - класс важнейших породообразующих минералов, составляющих около 80% массы земной коры. К неорганическим вяжущим материалам относятся цемент, гипс, известь и др. Молекулярные кристаллы инертных газов - элементов VIII группы периодической системы - испаряются при низких температурах, не переходя в жидкое состояние. Они находят применение в криоэлектронике, занимающейся созданием электронных приборов на основе явлений, которые имеют место в твердых телах при криогенных температурах.

Рис. 1.2. Расположение атомов в кристаллическом (а) и аморфном (б) веществе
Второй класс материалов составляют некристаллические твердые материалы . Ихразделяют по признаку упорядоченности и стабильности структуры на аморфные, стеклообразные и нестеклообразныые в полуразупорядоченном состоянии.
Типичными представителями аморфных материалов являются аморфные полупроводники, аморфные металлы и сплавы.
В группу стеклообразных материалов входят: ряд органических полимеров (полиметилакрилат при температурах ниже 105 °С, поливинилхлорид -ниже 82 °С и другие); многие неорганические материалы - неорганическое стекло на основе оксидов кремния, бора, алюминия, фосфора и т. д.; многие материалы для каменного литья - базальты и диабазы со стеклообразной структурой, металлургические шлаки, природные карбонаты с островной и цепочечной структурой (доломит, мергель, мрамор и др).
В нестеклообразном полуразупорядоченном состоянии находятся студни (структурированные системы полимер - растворитель, образующиеся при затвердевании растворов полимеров или набухании твердых полимеров), многие синтетические полимеры в высокоэластическом состоянии, каучуки и резины, большинство материалов на основе биополимеров, в том числе текстильные и кожевенные материалы, а также органические вяжущие материалы - битумы, дегти, пеки и др.
По функциональному назначению технические материалы делят на следующие группы.
Конструкционные материалы - твердые материалы, предназначенные для изготовления изделий, подвергаемых механическому воздействию. Они должны обладать комплексом механических свойств, обеспечивающих требуемые работоспособность и ресурс изделий при воздействии рабочей среды, температуры и других факторов.
Рис. 1.1. Классификация твердых кристаллических материалов по структурному признаку
Одновременно к ним предъявляют технологические требования, определяющие наименьшую трудоемкость изготовления деталей и конструкций, и экономические, касающиеся стоимости и доступности материала, что очень важно в условиях массового производства. К конструкционным материалам можно отнести металлы, силикаты и керамику, полимеры, резину, древесину, многие композиционные материалы.
Электротехнические материалы характеризуются особыми электрическими и магнитными свойствами и предназначены для изготовления изделий, применяемых для производства, передачи, преобразования и потребления электроэнергии. К ним относятся магнитные материалы, проводники, полупроводники, а также диэлектрики в твердой жидкой и газообразной фазах.
Триботехнические материалы предназначены для применения в узлах трения с целью регулирования параметров трения и изнашивания для обеспечения заданных работоспособности и ресурса этих узлов. Основными видами таких материалов являются смазочные, антифрикционные и фрикционные. К первым относят смазки в твердой (графит, тальк, дисульфид молибдена и др., жидкой (смазочные масла) и газообразной фазах (воздух, пары углеводородов и другие газы). В совокупность антифрикционных материалов входят сплавы цветных металлов (баббиты, бронзы и др.), серый чугун, пластмассы (текстолит, материалы на основе фторопластов и др.), металлокерамические композиционные материалы (бронзографит, железографит и др.), некоторые виды древесины и древесно-слоистых пластиков, резины, многие композиты. Фрикционные материалы имеют большой коэффициент трения и высокое сопротивление изнашиванию. К ним относятся некоторые виды пластмасс, чугунов, металлокерамики и других композиционных материалов.
Инструментальные материалы отличаются высокими показателями твердости, износоустойчивости и прочности, они предназначены для изготовления режущего, мерительного, слесарно-монтажного и другого инструмента. Сюда относятся такие материалы, как инструментальная сталь и твердые сплавы, алмаз и некоторые виды керамических материалов, многие композиционные материалы.
Рабочие тела - газообразные и жидкие материалы, с помощью которых энергию преобразуют в механическую работу, холод, теплоту. Рабочими телами служат водяной пар в паровых машинах и турбинах; аммиак, углекислота, фреон и другие хладагенты в холодильных машинах; масла в гидроприводе; воздух в пневматических двигателях; газообразные продукты сгорания органического топлива в газовых турбинах, двигателях внутреннего сгорания.
Топливо - горючие материалы, основной частью которых является углерод, применяемые с целью получения при их сжигании тепловой энергии. По происхождению топливо делят на природное (нефть, уголь, природный газ, горючие сланцы, торф, древесина) и искусственное (кокс, моторные топлива, генераторные газы и др.); по типу машин, в которых оно сжигается, - на ракетное, моторное, ядерное, турбинное и т. д.